Système thermodynamique
Ensemble macroscopique de particules, séparé du milieu « extérieur »
par une paroi. Cette paroi peut être physique, ou n'être qu'une création intellectuelle utile à l'étude du système.
Paramètre d'état extensif
Paramètre d'état du système proportionnel à la quantité de matière (
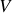 ,
,
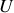 ,
,
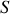 ,
,
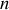 ,
,
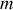 ...).
...).Un tel paramètre double lors de la réunion de deux systèmes identiques.
Paramètre d'état intensif
Paramètre d'état du système indépendant de la quantité de matière. Il peut être relié à un champ de forces extérieures (
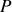 ), un champ thermique (
), un champ thermique (
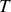 ) ou à la définition d'une quantité molaire ou massique (
) ou à la définition d'une quantité molaire ou massique (
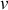 ,
,
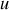 ,
,
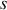 ,...).
,...).Un tel paramètre reste invariant lors de la réunion de deux systèmes identiques.
Variance
La variance d'un système thermodynamique désigne le nombre
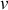 de paramètres d'état indépendants, nécessaires et suffisants à sa description macroscopique.
de paramètres d'état indépendants, nécessaires et suffisants à sa description macroscopique.Selon la règle de Gibbs, la variance est égale au nombre c de corps purs du système diminué du nombre de phases
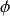 coexistant à l'équilibre et augmenté du nombre de champs appliqués au système (en général,
coexistant à l'équilibre et augmenté du nombre de champs appliqués au système (en général,
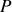 et
et
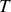 , soit :
, soit :
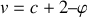 .
.
Potentiel thermodynamique
Les potentiels thermodynamiques (
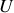 ,
,
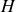 ,
,
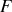 ,
,
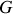 ) sont des fonctions d'état.
) sont des fonctions d'état.Ils caractérisent l'énergie du système considéré (1er principe) et sa tendance à occuper un état d'équilibre (2e principe).
Lorsque l'état d'équilibre est atteint, le potentiel est à son minimum.
Pour des systèmes adiabatiques, l'énergie interne
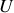 et l'enthalpie
et l'enthalpie
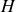 constituent les potentiels utiles.
constituent les potentiels utiles.Pour des systèmes monothermes, l'énergie libre
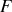 et l'enthalpie libre
et l'enthalpie libre
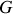 sont les potentiels les plus adaptés.
sont les potentiels les plus adaptés.À volume constant, on utilise les énergies
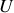 et
et
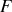 et à pression constante les enthalpies
et à pression constante les enthalpies
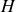 et
et
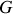 .
.
Potentiel chimique
Le potentiel chimique
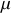 est la dérivée partielle d'un potentiel thermodynamique par rapport au nombre
est la dérivée partielle d'un potentiel thermodynamique par rapport au nombre
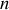 de moles.
de moles.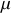 est égal à l'enthalpie libre molaire
est égal à l'enthalpie libre molaire
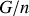 .
.Sa différentielle est
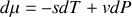 .
.Sa forme générale est
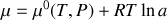 , où
, où
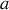 est l'activité chimique de l'espèce considérée.
est l'activité chimique de l'espèce considérée.La relation de Gibbs-Duhem pour
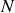 espèces
espèces
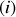 est de la forme
est de la forme
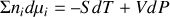 .
.




