On constate en physique nucléaire qu'un nucléon lié, c'est-à-dire contenu dans un noyau, est plus léger qu'un nucléon libre, c'est-à-dire pris isolément en dehors d'un noyau.
Ainsi par exemple la masse moyenne d'un nucléon lié dans le noyau de carbone 12 est par définition égale à 1 unité de masse atomique (uma) soit
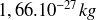 alors que la masse du proton et la masse du neutron libres sont toutes les deux supérieures à 1 uma !
alors que la masse du proton et la masse du neutron libres sont toutes les deux supérieures à 1 uma !
Masse du proton libre :
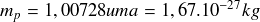
Masse du neutron libre :
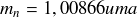
Une conséquence directe de ce phénomène est que la masse du noyau est inférieure à la somme des masses de ses constituants pris séparément au repos.
On appelle défaut de masse la différence entre la masse des nucléons qui constituent le noyau pris au repos et la masse du noyau :
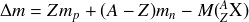
Dans cette expression :
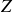 désigne le numéro atomique du nucléide X considéré
désigne le numéro atomique du nucléide X considéré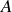 est le nombre de masse
est le nombre de masse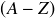 est le nombre de neutrons
est le nombre de neutrons
Complément : Pour aller plus loin...
Défaut de masse et Excès de masse
En Physique Nucléaire, on utilise souvent une notion mathématique appelée « excès de masse atomique » qui ne doit pas être confondue avec le « défaut de masse » vu dans ce cours. La définition de l'excès de masse
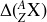 pour un atome
pour un atome
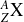 , de numéro atomique Z et de nombre de masse A, est la suivante :
, de numéro atomique Z et de nombre de masse A, est la suivante :
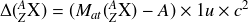
Dans cette expression
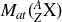 désigne la masse de l'atome en unité de masse atomique, u l'unité de masse atomique et c la célérité de la lumière dans le vide. L'excès de masse s'exprime donc comme une énergie. Il est le plus souvent donné en MeV (dans ce cas on utilise la relation
désigne la masse de l'atome en unité de masse atomique, u l'unité de masse atomique et c la célérité de la lumière dans le vide. L'excès de masse s'exprime donc comme une énergie. Il est le plus souvent donné en MeV (dans ce cas on utilise la relation
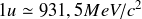 ).
).
Par exemple l'excès de masse de l'oxygène 16 est :
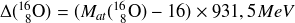
L'utilisation de l'excès de masse est très pratique en Physique Nucléaire mais reste toutefois très spécifique, aussi pour éviter toute confusion cette notion ne sera pas détaillée dans ce cours.




