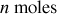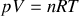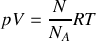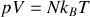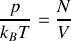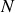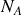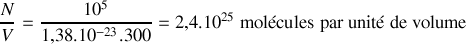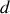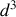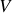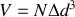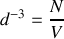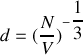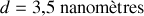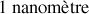Énoncé
On considère un gaz réel constitué d'un grand nombre de molécules qui ont un rayon de l'ordre de
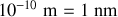 . Le gaz est à la pression
. Le gaz est à la pression
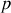 et à la température
et à la température
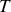 .
.
Dans un premier temps, on considère que ce gaz est parfait.
Calculer le nombre de molécules par unité de volume.
Calculer la distance moyenne entre molécules.
On se place à pression et température ambiantes:
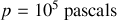 ,
,
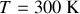 .
. On donne la constante de Boltzmann:
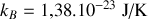 .
.L'énergie potentielle d'interaction entre molécules est attractive à partir d'une distance égale à deux fois le rayon des molécules. Parce que cette énergie potentielle varie suivant une loi en
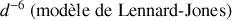 , on considère qu'au-delà d'une distance d'une dizaine de fois le rayon des molécules, cette interaction est négligeable.
, on considère qu'au-delà d'une distance d'une dizaine de fois le rayon des molécules, cette interaction est négligeable. En prenant en compte ces considérations, discuter de la validité de l'hypothèse de gaz parfait pour ce gaz.