On rappelle la définition de la chaleur de réaction Q :
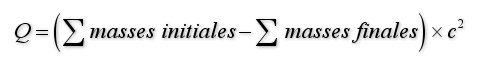
On peut faire le calcul du Q de réaction dans le Système International (M.K.S.A), dans ce cas on utilise des masses en kg et la valeur de la vitesse de la lumière dans le vide
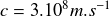 . On obtient alors une énergie Q en joules.
. On obtient alors une énergie Q en joules.
En physique nucléaire, on préfère souvent un autre système d'unités. On utilise des masses en
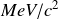 et on obtient alors directement Q en MeV.
et on obtient alors directement Q en MeV.
On rappelle que
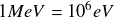 et
et
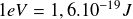 .
.
Comparaison avec la Chimie
En Chimie, les réactions subies par des atomes ou molécules mettent en jeu la rupture et/ou la création de liaisons covalentes (ou autres). L'énergie libérée par une réaction chimique exothermique est généralement de l'ordre de l'électron-volt, elle est donc de plusieurs ordres de grandeur plus faible que l'énergie libérée par une réaction nucléaire.
En Chimie, on considère généralement l'aspect macroscopique d'une grande quantité de réactifs (de l'ordre de la mole, avec
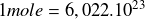 ) plutôt que l'aspect microscopique d'atomes ou de molécules pris individuellement. En conséquence l'énergie libérée par un échantillon macroscopique subissant une réaction exothermique est exprimée en joules (dans le Système International) ou bien en calories (
) plutôt que l'aspect microscopique d'atomes ou de molécules pris individuellement. En conséquence l'énergie libérée par un échantillon macroscopique subissant une réaction exothermique est exprimée en joules (dans le Système International) ou bien en calories (
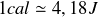 ).
).




