Revenons sur les valeurs de masses données précédemment :
Unité de masse atomique :
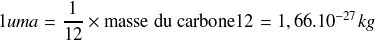
Masse du proton :
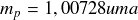
Masse du neutron :
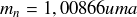
Nous avons vu que l'unité de masse atomique représente approximativement la masse moyenne d'un nucléon (proton ou neutron) dans un noyau. On pourrait donc s'attendre à ce que la valeur de 1 uma soit comprise entre la masse du proton et la masse du neutron données ci-dessus. Or on voit que cela n'est pas le cas : si on fait la moyenne de la masse du proton et du neutron, on obtient une valeur supérieure à 1 uma !
Explication : Comment expliquer ce paradoxe ?
Pour expliquer ce paradoxe, il faut faire la distinction entre un nucléon libre, c'est-à-dire isolé, seul, en-dehors d'un noyau, et un nucléon lié, c'est-à-dire contenu dans un noyau au milieu d'autres nucléons.
On constate en Physique Nucléaire que la masse d'un nucléon lié est toujours inférieure à la masse d'un nucléon libre.
Les masses du proton ou du neutron données ci-dessus sont celles du proton et du neutron libres. On constate qu'elles sont toutes les deux légèrement supérieures à 1 uma.
Dans le noyau de carbone 12 en revanche, 1 uma représente bien (si l'on néglige la masse des électrons) la masse moyenne du proton et du neutron liés dans ce noyau.
Comment s'explique cette perte de masse entre un nucléon libre (plus lourd) et un nucléon qui se trouve dans un noyau (plus léger) ? Nous allons voir que cette diminution de la masse est le signe de l'existence d'une énergie qui maintient les nucléons liés entre eux dans le noyau. On appelle cette énergie une « énergie de liaison ». C'est elle qui assure la cohésion du noyau.




