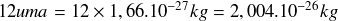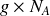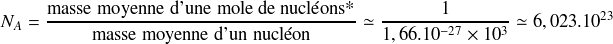La masse d'un atome de carbone 12, qui contient 12 nucléons, est :
|
|---|
De plus la masse d'une mole de carbone 12 est 12 g/mol.
Ceci est généralisable en première approximation aux autres nucléides. Par exemple, de même, dire que la masse d'un atome d'uranium 235 est d'environ 235 uma est équivalent à dire que la masse molaire de l'uranium 235 est d'environ 235 g/mol.
On voit donc qu'il existe un lien direct entre masse atomique et masse molaire.
masse d'un atome en u.m.a. = masse molaire en g/mol |
|---|
Comme 1 mole d'atomes contient un nombre d'atomes égal à
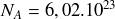 (nombre d'Avogadro), on a la relation suivante :
(nombre d'Avogadro), on a la relation suivante :
masse molaire en g/mol = masse d'un atome en
|
|---|
Exemple : Exemple pour le carbone 12 :
Masse molaire du carbone 12
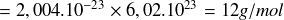
Généralisation :
Par définition, le nombre d'Avogadro est donc égal à l'inverse de 1 uma en grammes :
|
|---|
* sous entendu : masse moyenne des nucléons dans le carbone 12...