On peut enfin constater une autre similitude intéressante :
En Physique Atomique, on constate des pics de potentiel d'ionisation
Complément : Potentiel d'ionisation des atomes

Evolution du potentiel d'ionisation (en électron-volts) des atomes, de l'hydrogène au radon, en fonction du numéro atomique Z de l'élément.
Les maxima de potentiel d'ionisation correspondent aux éléments que l'on peut le moins facilement ioniser (gaz rares – en vert). Les minima correspondent aux éléments les plus faciles à ioniser (alcalins – en bleu).
Pour certains atomes particuliers appelés « gaz rares » ou « gaz nobles » : Hélium, Néon, Argon, Krypton, Xénon, Radon, correspondant aux numéros atomiques respectifs Z = 2, 10, 18, 36, 54, 86. Ces maxima de potentiel d'ionisation correspondent à des atomes très peu réactifs du point de vue chimique, car la couche électronique périphérique, contenant les électrons de valence, est complète. Il est de ce fait plus difficile d'arracher un électron à ces atomes.
En Physique Nucléaire, on constate de même des maxima (locaux) d'énergie de séparation
Complément : Energie de séparation des isotopes du plomb
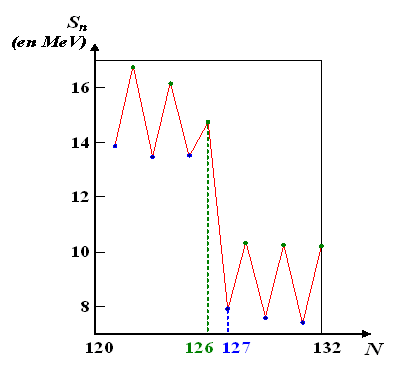
Evolution de l'énergie de séparation du dernier neutron (en MeV) des isotopes du plomb, en fonction du nombre de neutrons N de l'isotope.
Alors que pour
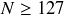 l'énergie de séparation reste globalement au même niveau (autour de 8 à 10 MeV), pour le « nombre magique »
l'énergie de séparation reste globalement au même niveau (autour de 8 à 10 MeV), pour le « nombre magique »
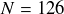 elle augmente brusquement jusqu'à 15 MeV environ. L'isotope du plomb possédant 126 neutrons (c'est-à-dire le plomb 208, qui est l'isotope stable du plomb le plus lourd) correspond en effet à un noyau dont la dernière couche quantique en neutrons est complètement remplie. Il est de ce fait plus difficile de lui arracher un neutron. Au contraire, pour les noyaux de
elle augmente brusquement jusqu'à 15 MeV environ. L'isotope du plomb possédant 126 neutrons (c'est-à-dire le plomb 208, qui est l'isotope stable du plomb le plus lourd) correspond en effet à un noyau dont la dernière couche quantique en neutrons est complètement remplie. Il est de ce fait plus difficile de lui arracher un neutron. Au contraire, pour les noyaux de
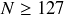 on commence à remplir une nouvelle couche de neutrons, qui sont donc plus faciles à arracher.
on commence à remplir une nouvelle couche de neutrons, qui sont donc plus faciles à arracher.
Remarque :
On peut noter de façon plus fine des « oscillations » en dents de scie de l'énergie de séparation en fonction du nombre de neutrons : elle a tendance à augmenter localement lorsque le nombre de neutrons est pair (points verts) et à diminuer lorsque le nombre de neutrons est impair (points bleus). Cet effet de la parité est un effet remarquable en Physique Nucléaire : un nombre pair de neutrons (ou de protons) a tendance à stabiliser la structure du noyau.
Et aussi d'énergie de liaison par nucléon pour certains noyaux dont les couches externes (en protons ou en neutrons) sont complètement remplies. Les noyaux concernés sont donc particulièrement liés, il est plus difficile de leur enlever un nucléon. On parle de « noyaux magiques ». Le noyau atomique étant un objet physique très différent de l'atome, les valeurs de nombres de protons Z et de neutrons N sont différentes des précédentes.
Ces « nombres magiques » sont : N (ou Z) = 2, 8, 20, 28, 50, 82, 126
Ce phénomène est exacerbé pour les noyaux « doublement magiques », c'est-à-dire pour lesquels à la fois Z et N sont magiques.
Citons :
Hélium 4
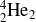
Oxygène 16
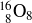
Calcium 40
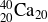
Plomb 208





