Bien que les expériences sur les spectres d'émission des atomes ont fait l'objet de mesures avant 1900, le premier modèle atomique a été suggéré par Bohr en 1913 et appliqué à l'atome d'hydrogène (système lié électron-proton). Ce modèle a permis d'établir la quantification des niveaux d'énergie de l'atome et d'expliquer des résultats antérieurs relatifs au spectre d'émission dans l'UV (série de Lyman), dans le visible (série de Balmer) ou dans l'IR (série de Paschen),...L'ensemble de ces résultats spectroscopiques sur le spectre d'émission de l'hydrogène atomique obéit à une relation établie de façon empirique par Rydberg-Ritz en 1888 et donnant la fréquence des radiations observées sous la forme :
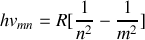
Avec
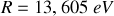
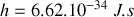
et
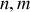 entiers positifs avec
entiers positifs avec
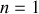 pour la série de Lyman,
pour la série de Lyman,
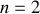 pour la série de Balmer et
pour la série de Balmer et
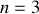 pour la série de Paschen.
pour la série de Paschen.
Le modèle de Bohr et la contribution de Sommerfeld offraient une interprétation rationnelle à ces résultats sur la base d'un mouvement planétaire de l'électron autour du proton et de l'hypothèse d'une règle de quantification du moment cinétique. Cette règle qui a été imposée « ad-hoc » dans le modèle de Bohr se trouve de façon naturelle dans la mécanique quantique développée ultérieurement. Aussi, le modèle de Bohr ne peut être assimilé à la théorie quantique et son mérite est d'avoir introduit la notion de quantification des niveaux d'énergie atomiques.
Modèle de Bohr
Le modèle planétaire de Bohr considère le mouvement de l'électron qui gravite autour du proton confondu avec le centre de masse et constituant un centre attracteur (force électrique). Le mouvement est donc celui d'une particule dans un champ central (
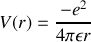 ) qui peut être analysé dans le cadre de la mécanique analytique brièvement introduite dans le paragraphe suivant.
) qui peut être analysé dans le cadre de la mécanique analytique brièvement introduite dans le paragraphe suivant.



