Exemple 1 : désintégration du carbone 14
Les isotopes stables du carbone sont le carbone 12 et le carbone 13 (avec une abondance naturelle de 98,9 % de carbone 12). Le carbone 14 présente un excès de neutrons par rapport à ces isotopes stables. Il se désintègre donc par radioactivité
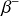 :
:
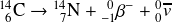
Le noyau fils formé possède
 protons, il s'agit donc d'un isotope de l'azote. De plus il possède 14 nucléons, on obtient donc de l'azote 14. L'azote 14 est un isotope stable.
protons, il s'agit donc d'un isotope de l'azote. De plus il possède 14 nucléons, on obtient donc de l'azote 14. L'azote 14 est un isotope stable.
On voit que l'on a ainsi réalisé une transmutation (le passage d'un élément à un autre) du carbone en azote.
Exemple 2 : désintégration de l'oxygène 20
Les isotopes stables de l'oxygène sont l'oxygène 16, 17 et 18 (avec une abondance naturelle de 99,8 % d'oxygène 16). L'oxygène 20 présente un excès de neutrons par rapport à ces isotopes stables. Il va donc de même se désintégrer par radioactivité
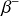 :
:

Le noyau fils possède
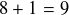 protons donc il s'agit d'un isotope du fluor. De plus il possède 20 nucléons, on obtient donc du fluor 20. Le fluor 20 est lui-même un isotope instable. Il se désintègre par radioactivité
protons donc il s'agit d'un isotope du fluor. De plus il possède 20 nucléons, on obtient donc du fluor 20. Le fluor 20 est lui-même un isotope instable. Il se désintègre par radioactivité
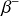 :
:
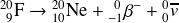
Le noyau petit-fils possède
 protons et 20 nucléons, il s'agit donc du néon 20. Le néon 20 est un isotope stable donc la chaîne radioactive s'arrête là. On dit que le fluor 20 et le néon 20 sont des descendants de l'oxygène 20, c'est-à-dire qu'ils font partie de sa filiation radioactive.
protons et 20 nucléons, il s'agit donc du néon 20. Le néon 20 est un isotope stable donc la chaîne radioactive s'arrête là. On dit que le fluor 20 et le néon 20 sont des descendants de l'oxygène 20, c'est-à-dire qu'ils font partie de sa filiation radioactive.
Exemple 3 : désintégration du neutron
Le neutron libre, c'est-à-dire non lié à d'autres nucléons, n'est pas stable.
Il existe en fait dans la nature seulement deux endroits où les neutrons sont stables. Ce sont des systèmes où les neutrons sont liés, c'est-à-dire où ils sont associés entre eux. Ces deux endroits sont :
les noyaux (association de neutrons et protons liés),
à beaucoup plus grande échelle, les étoiles à neutrons (association de neutrons entre eux).
Le neutron libre, lui, est instable. Au bout d'un certain temps (de l'ordre de 15 minutes en moyenne), il finit par se désintégrer par radioactivité
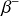 selon l'équation suivante :
selon l'équation suivante :
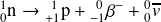
Remarque :
Cette équation de désintégration montre que le neutron est forcément plus lourd que le proton - la différence de masse entre les deux étant toutefois très faible :
Masse du neutron : 1,008665 u.m.a
Masse du proton : 1,007825 u.m.a




