On considère deux réservoirs identiques aux parois rigides et parfaitement thermofuges. Ils communiquent par un tube à robinet. On note
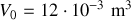 le volume d'un réservoir. À l'état initial le compartiment noté A contient une mole de gaz parfait à la température
le volume d'un réservoir. À l'état initial le compartiment noté A contient une mole de gaz parfait à la température
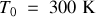 et le compartiment B est vide. La pression initiale est notée
et le compartiment B est vide. La pression initiale est notée
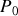 .
.
On ouvre le robinet. Le gaz se répartit dans les deux réservoirs, et atteint un nouvel équilibre thermodynamique. On note
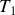 la température finale et
la température finale et
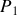 la pression finale.
la pression finale.
Question 1
Expliciter pour le gaz parfait la variation d'énergie interne
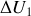 , le travail des forces de pression
, le travail des forces de pression
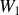 et le transfert thermique
et le transfert thermique
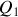 qui accompagnent éventuellement la transformation. Déterminer
qui accompagnent éventuellement la transformation. Déterminer
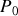 ,
,
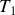 et
et
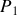 en fonction des données et faire les applications numériques.
en fonction des données et faire les applications numériques.
Question 2
Exprimer puis calculer numériquement la variation d'entropie
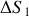 du gaz parfait lors de cette détente de Joule & Gay-Lussac.
du gaz parfait lors de cette détente de Joule & Gay-Lussac.
Question 3
En déduire la variation d'entropie de l'Univers
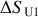 . Ce résultat précédent est-il conforme au second principe de la thermodynamique ? Justifier.
. Ce résultat précédent est-il conforme au second principe de la thermodynamique ? Justifier.



