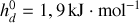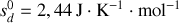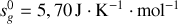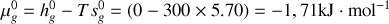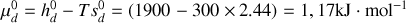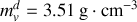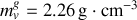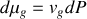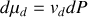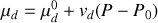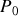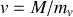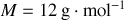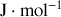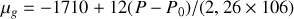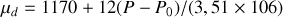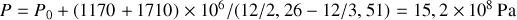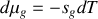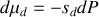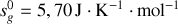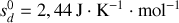Exemple de transition de phase : graphite et diamant
Dans les conditions ambiantes de température et de pression, le carbone se structure en phase graphite sous forme de feuillets plans non compacts, les graphènes. Par des liaisons covalentes de type
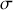 et
et
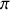 , chaque atome de carbone est fortement lié aux atomes qui complètent avec lui une maille hexagonale du feuillet. Entre les feuillets, les liaisons sont de van der Waals. La force des premières liaisons (dans le plan) et la faiblesse des secondes (entre les plans) expliquent à la fois la faible dureté du graphite et la possibilité de le cliver.
, chaque atome de carbone est fortement lié aux atomes qui complètent avec lui une maille hexagonale du feuillet. Entre les feuillets, les liaisons sont de van der Waals. La force des premières liaisons (dans le plan) et la faiblesse des secondes (entre les plans) expliquent à la fois la faible dureté du graphite et la possibilité de le cliver.
Sous très haute pression, le carbone cristallise dans un système dérivé du cubique à faces centrées, nommé diamant, dans lequel chaque atome est au centre d'un tétraèdre dont les sommets sont ses plus proches voisins. Cette structure explique la grande dureté tridimensionnelle du diamant. Comme le graphite, la phase diamant existe aux pressions ordinaires et les deux cristaux sont décrits comme des variétés allotropiques du carbone solide. Cependant, le diamant n'est pas thermodynamiquement stable.
Question
Métastabilité du diamant |
|---|
Montrer qu'à température et pression ordinaires, la phase diamant ne peut être que métastable. Pour ce faire, on calculera pour chaque phase les potentiels chimiques [les enthalpies libres molaires] à 300 K. On donne les enthalpies et entropies molaires standards :
|
Question
Pression de transition |
|---|
Graphite et diamant étant supposés incompressibles, calculer à partir de quelle pression, à température ambiante, le diamant devient la phase naturelle (stable) du cristal carbone. Application numérique :
|
Question
Température de transition |
|---|
Cette pression de transition diminue-t-elle ou augmente-t-elle si la température augmente ? |