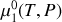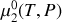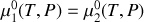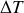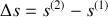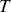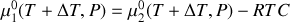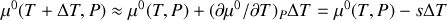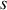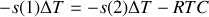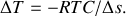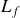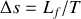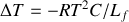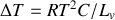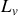Exemple d'équilibre chimique : loi de Raoult
On considère un réservoir contenant une solution (2) constituée de
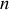 moles de solvant et de
moles de solvant et de
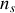 moles de soluté (
moles de soluté (
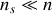 ) et une phase solide (1) constituée du seul solvant. On désignera par
) et une phase solide (1) constituée du seul solvant. On désignera par
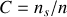 la concentration de soluté dans la solution (2). La pression du système est la pression atmosphérique extérieure, supposée constante.
la concentration de soluté dans la solution (2). La pression du système est la pression atmosphérique extérieure, supposée constante.
Question
Équilibre chimique du solvant pur |
|---|
Dans un premier temps, la solution est réduite au solvant pur (sans soluté). En déduire une relation entre les potentiels chimiques
|
Question
Refroidissement par dilution |
|---|
On dilue le soluté dans le solvant en phase liquide. Une diminution de la température
|
Question
Loi cryométrique de Raoult |
|---|
Soit
|