Question 1
a) Si l'opérateur veille à ce que la pression extérieure reste très voisine de la pression du gaz à l'intérieur du cylindre, alors la transformation est quasi-statique. De plus, les transferts thermiques ont également le temps de se produire et à tout instant la température du gaz reste égale à celle du thermostat. La transformation est donc une isotherme quasi-statique, a priori réversible.
b) On a
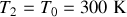 et
et
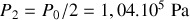 ;
;
Par suite pour ce gaz parfait :
 .
.
c) En raison de la première loi de Joule du gaz parfait, il vient pour une isotherme :
 .
.
Par suite,
 alors que
alors que
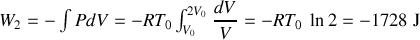
d) Pour ce doublement isotherme du volume du gaz parfait,
 .
.
e) La variation d'entropie du thermostat est
 , soit
, soit
 . Il n'y a donc aucune variation d'entropie de l'Univers (
. Il n'y a donc aucune variation d'entropie de l'Univers (
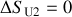 ). La transformation est bien réversible.
). La transformation est bien réversible.
Question 2
a) Si l'opérateur lâche brusquement le piston, la pression extérieure devient brusquement égale à
 , et il existe une différence finie de pression jusqu'à ce que le gaz se soit suffisamment détendu pour descendre à cette pression. Lors de cette première étape, les transferts thermiques n'ont pas le temps de se produire et la transformation est donc adiabatique non quasi-statique (irréversible).
, et il existe une différence finie de pression jusqu'à ce que le gaz se soit suffisamment détendu pour descendre à cette pression. Lors de cette première étape, les transferts thermiques n'ont pas le temps de se produire et la transformation est donc adiabatique non quasi-statique (irréversible).
Ensuite, les transferts thermiques se font depuis le thermostat, car le gaz s'est refroidi au cours de la détente, et le volume de ce gaz augmente encore, cette fois de façon isobare, du fait de sa dilatation thermique. Ces transferts entre deux systèmes à deux températures distinctes sont également irréversibles a priori.
L'entropie de l'Univers augmente.
b) On a encore
 et par suite
et par suite
 .
.
De même la pression « finale » est
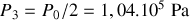 et le volume final reste
et le volume final reste
 .
.
Le travail se calcule aisément car la pression extérieure reste égale à
 tout au long de la transformation :
tout au long de la transformation :
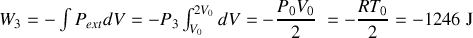
Quant au transfert thermique, il est donné par
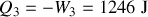 .
.
c) Pour ce doublement monotherme du volume du gaz parfait,
 .
.
d) La variation d'entropie du thermostat est
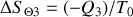 , soit
, soit
 .
.
Il existe donc une augmentation d'entropie de l'Univers (entropie créée) égale à
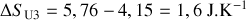 . La transformation est bien irréversible.
. La transformation est bien irréversible.



