Par définition de la température thermodynamique et d'après le postulat de Nernst-Planck, qui implique une croissance de l'entropie avec la température, il apparaît que les dérivées premières et secondes de l'énergie interne et de l'enthalpie par rapport à l'entropie sont positives :
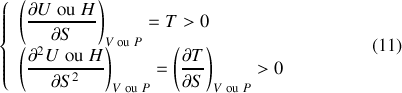
De là, il est aisé de déduire l'allure générale de la courbe de stabilité de l'énergie interne ou de l'enthalpie d'un système en fonction de l'entropie. À droite de la courbe de stabilité représentée à la figure 2, l'entropie prend une valeur plus grande que la valeur de l'entropie à l'équilibre. Or, selon le deuxième principe, l'entropie est maximale à l'équilibre. La zone à droite de la courbe est donc interdite au système. En revanche, des états instables sont permis à gauche de la courbe (aire d'instabilité).
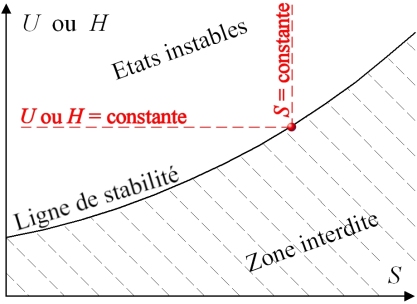
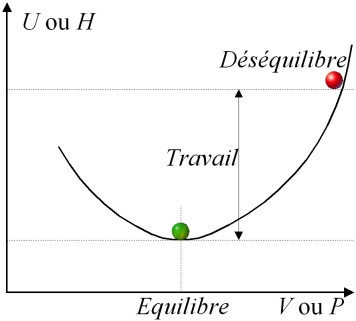
La figure 2 montre que, à énergie interne ou enthalpie constantes (cas du système isolé), l'entropie est maximale à l'équilibre. De plus, pour une entropie donnée, l'énergie du système est plus grande pour un état situé dans l'aire d'instabilité que pour l'état situé sur la courbe de stabilité. À entropie constante, toute évolution du système vers son état d'équilibre se traduit donc par une diminution de l'énergie. Une telle évolution vers un minimum de l'énergie rappelant l'évolution spontanée de l'énergie potentielle vers un minimum dans les systèmes mécaniques, on nomme « potentiels thermodynamiques »
les fonctions
 et
et
 . Ce résultat est schématisé par la figure 3, qui donne l'évolution de
. Ce résultat est schématisé par la figure 3, qui donne l'évolution de
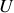 (ou
(ou
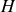 ) en fonction de
) en fonction de
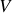 (ou
(ou
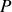 ) à entropie constante. L'état du système y est représenté par une petite boule, qui tend à occuper la position la plus basse (l'équilibre). Il importe ici de relever qu'à entropie constante (transformation adiabatique quasi-statique), l'énergie échangée est égale au travail quasi-statique (volumétrique pour l'énergie interne et technique pour l'enthalpie) :
) à entropie constante. L'état du système y est représenté par une petite boule, qui tend à occuper la position la plus basse (l'équilibre). Il importe ici de relever qu'à entropie constante (transformation adiabatique quasi-statique), l'énergie échangée est égale au travail quasi-statique (volumétrique pour l'énergie interne et technique pour l'enthalpie) :
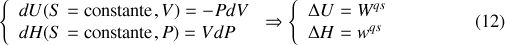
Compte tenu de l'inégalite (7) entre travaux quasi-statique et non quasi-statique, il en découle en règle générale :
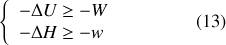
Les travaux
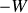 et
et
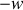 sont ceux échangés par l'opérateur. Les variations
sont ceux échangés par l'opérateur. Les variations
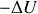 et
et
 sont donc les quantités de travail que l'opérateur peut récupérer ou dépenser dans la configuration optimale au cours d'une transformation adiabatique (le cas quasi-statique, ici réversible). L'énergie interne et l'enthalpie sont des
sont donc les quantités de travail que l'opérateur peut récupérer ou dépenser dans la configuration optimale au cours d'une transformation adiabatique (le cas quasi-statique, ici réversible). L'énergie interne et l'enthalpie sont des « potentiels pour le travail adiabatique »
. Par ailleurs, compte tenu de l'inégalité (9), il est possible d'écrire pour l'énergie interne comme pour l'enthalpie :
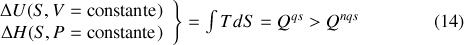
Aussi,
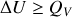 à volume constant et
à volume constant et
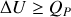 à pression constante. L'énergie interne et l'enthalpie sont également des
à pression constante. L'énergie interne et l'enthalpie sont également des « potentiels pour le transfert thermique »
. L'enthalpie est la fonction d'état la plus utilisée en thermochimie car la plupart des opérations y sont réalisées à pression constante. Elle y est donc souvent assimilée à l'énergie échangée par chaleur (4).




