Les capacités thermiques absolues
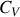 et
et
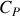 et les coefficients thermiques
et les coefficients thermiques
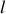 et
et
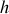 d'un système sont définis par la relation du transfert thermique quasi-statique à la variation d'entropie :
d'un système sont définis par la relation du transfert thermique quasi-statique à la variation d'entropie :
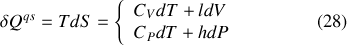
Des différentielles (1) et des relations de Gibbs-Helmholtz, il est donc loisible de déduire des relations entre capacités thermiques et potentiels thermodynamiques :
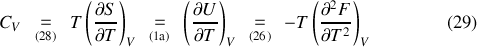
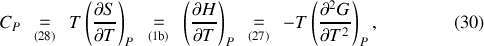
tandis que l'utilisation des relations de Maxwell (23) et (24) permet de retrouver les « relations de Clapeyron »
définissant les coefficients thermiques
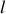 et
et
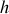 en fonction de dérivées partielles du volume ou de la pression :
en fonction de dérivées partielles du volume ou de la pression :
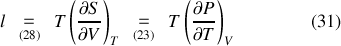
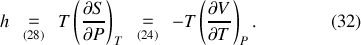
L'entropie
 étant une dérivée partielle de l'énergie libre
étant une dérivée partielle de l'énergie libre
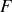 comme de l'enthalpie libre
comme de l'enthalpie libre
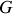 , il est également possible de définir les coefficients thermiques
, il est également possible de définir les coefficients thermiques
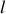 et
et
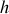 en fonction de la dérivée seconde, mixte dans ce cas, d'un potentiel libre :
en fonction de la dérivée seconde, mixte dans ce cas, d'un potentiel libre :
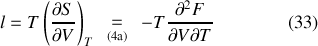

Enfin, les coefficients thermoélastiques
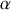 (dilatation isochore),
(dilatation isochore),
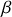 (dilatation isobare) et
(dilatation isobare) et
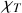 (compressibilité isotherme) apparaissent eux aussi susceptibles d'être exprimés en fonction des dérivées secondes de
(compressibilité isotherme) apparaissent eux aussi susceptibles d'être exprimés en fonction des dérivées secondes de
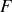 et
et
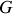 :
:
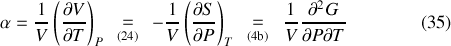

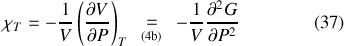
Le coefficient de compressibilité isentropique dérive quant à lui de l'enthalpie
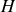 :
:
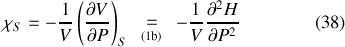
Ce sont donc tous les coefficients thermiques utiles à l'étude des systèmes qui dérivent des potentiels thermodynamiques, c'est à dire des deux concepts centraux que sont l'énergie et l'entropie.




