On a montré précédemment que l'énergie interne et l'enthalpie était des potentiels pour le travail adiabatique. Les potentiels
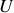 et
et
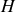 sont donc adaptés à l'étude de systèmes thermiquement isolés. Il existe d'autres cas de figure importants dans la nature, pour lesquels ces deux fonctions sont moins intéressantes. Considérons en particulier la situation où le système
sont donc adaptés à l'étude de systèmes thermiquement isolés. Il existe d'autres cas de figure importants dans la nature, pour lesquels ces deux fonctions sont moins intéressantes. Considérons en particulier la situation où le système
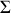 étudié est en contact avec un thermostat
étudié est en contact avec un thermostat
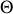 . Deux situations idéales peuvent être considérées, selon que le volume du système
. Deux situations idéales peuvent être considérées, selon que le volume du système
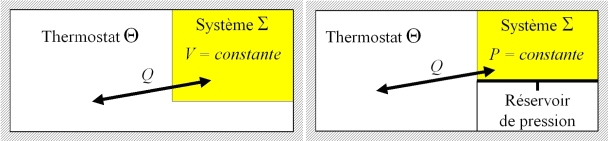
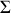 est constant ou que sa pression est maintenue constante. Elles sont représentées par la figure 4. L'ensemble
est constant ou que sa pression est maintenue constante. Elles sont représentées par la figure 4. L'ensemble
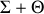 étant isolé, toute évolution du système
étant isolé, toute évolution du système
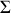 vers son état d'équilibre s'accompagne d'une augmentation de l'entropie de l'Univers :
vers son état d'équilibre s'accompagne d'une augmentation de l'entropie de l'Univers :
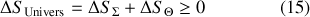
Or, la variation d'entropie du thermostat
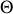 se résume au rapport
se résume au rapport
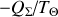 . Par suite,
. Par suite,
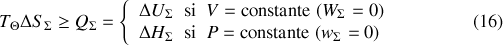
Toute transformation monotherme d'un système
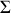 s'accompagne donc des inégalités :
s'accompagne donc des inégalités :
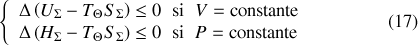
Dans l'hypothèse où le système
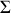 est à la température du thermostat
est à la température du thermostat
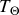 en son état initial et en son état final, cela conduit à l'important résultat (18).
en son état initial et en son état final, cela conduit à l'important résultat (18).

Toute évolution spontanée vers un état d'équilibre d'un système en contact avec un thermostat (transformation monotherme) s'accompagne d'une diminution de l'énergie libre
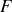 (à volume constant) ou de l'enthalpie libre
(à volume constant) ou de l'enthalpie libre
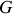 (à pression constante).
(à pression constante).
Les fonctions
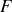 et
et
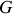 sont donc minimales à l'équilibre (
sont donc minimales à l'équilibre (
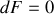 et
et
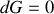 ). Cette autre expression du principe d'évolution qu'est le second principe montre que
). Cette autre expression du principe d'évolution qu'est le second principe montre que
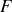 et
et
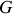 sont des potentiels adaptés à l'étude de systèmes en contact avec une source thermique. En particulier,
sont des potentiels adaptés à l'étude de systèmes en contact avec une source thermique. En particulier,
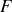 et
et
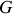 sont des potentiels pour le travail des transformations monothermes (en contact avec un thermostat). Pour le montrer, considérons tout d'abord le cas idéal d'une transformation quasi-statique isotherme et donc réversible :
sont des potentiels pour le travail des transformations monothermes (en contact avec un thermostat). Pour le montrer, considérons tout d'abord le cas idéal d'une transformation quasi-statique isotherme et donc réversible :
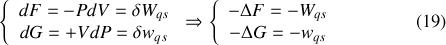
Dans le cas monotherme, pas nécessairement isotherme quasi-statique, l'inégalité (7) entraîne :
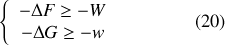
Les travaux
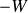 et
et
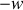 étant ceux échangés par l'opérateur, les quantités
étant ceux échangés par l'opérateur, les quantités
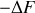 et
et
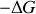 sont les quantités de travail que l'opérateur récupère ou dépense dans la configuration optimale d'une transformation monotherme (c'est à dire dans le cas de l'isotherme réversible).
sont les quantités de travail que l'opérateur récupère ou dépense dans la configuration optimale d'une transformation monotherme (c'est à dire dans le cas de l'isotherme réversible).
Remarque :
C'est dans ce dernier résultat que l'origine du qualificatif « libre »
attribué aux potentiels
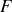 et
et
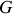 doit être comprise. Le travail est en effet ce qui intéresse l'opérateur utilisant une machine thermique. Cette énergie peut être utilisée en mécanique (force motrice) comme en thermique (chauffage). A contrario, l'énergie thermique, si elle peut bien sûr avoir une utilisation thermique, ne peut être intégralement convertie en travail (second principe). En ce sens elle est une quantité d'énergie
doit être comprise. Le travail est en effet ce qui intéresse l'opérateur utilisant une machine thermique. Cette énergie peut être utilisée en mécanique (force motrice) comme en thermique (chauffage). A contrario, l'énergie thermique, si elle peut bien sûr avoir une utilisation thermique, ne peut être intégralement convertie en travail (second principe). En ce sens elle est une quantité d'énergie « liée »
. Si on assimile cette énergie liée au produit
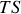 , il apparaît que
, il apparaît que
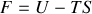 et
et
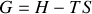 sont libres parce qu'on leur a soustrait la partie liée.
sont libres parce qu'on leur a soustrait la partie liée.




