Grace à des avancées techniques à la fin du 19e siècle pour établir un vide dans un équipement et à la maîtrise des expériences de déflexion de charges par des champs électrique et magnétique autour de cet équipement.
Rappel :
J.J. Thomson a découvert l'électron en 1897 grâce à une expérience importante qui lui a valu le prix Nobel.
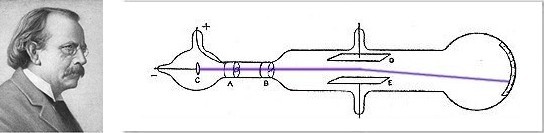
L'électron est une particule négativement chargée, environ deux mille fois plus légère qu'un atome de l'Hydrogène.
J.J. Thomson arrive à mesurer le rapport entre la charge et la masse de l'électron mais sans parvenir à séparer ces deux valeurs. Estimant la masse de l'électron, Thomson croyait initialement que l'atome de l'Hydrogène devait être donc composé d'environ deux mille électrons afin d'expliquer sa masse. Mais un atome constitué de plusieurs milliers d'électrons aurait une très haute charge négative et cela n'a jamais été observé puisque la matière et ses atomes sont habituellement neutres.
En 1906 Thomson a suggéré que les atomes contenaient surement moins d'électrons, proposant un nombre approximatif égal au nombre atomique. En effet, dans le cas d'Hydrogène c'est seulement un électron, moins que les milliers suggérés initialement !
Thomson et d'autres scientifiques à l'époque savaient que les électrons étaient équilibrés par des charges positives à l'intérieure d'atomes. Ils attribuaient aux atomes constituant la matière une forme sphérique de diamètre d'environ
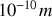 . Mais ils n'avaient pas d'idées claires sur la structure de l'atome. En effet, la distribution de charge et de masse dans l'atome était alors inconnue.
. Mais ils n'avaient pas d'idées claires sur la structure de l'atome. En effet, la distribution de charge et de masse dans l'atome était alors inconnue.
Thomson a proposé un modèle atomique appelé pudding de prune : la charge positive de l'atome remplissant une forme atomique supposée sphérique et la charge négative éparpillée comme des cerises dans le pudding. Ce modèle du pudding de prune a été accepté généralement pendant un temps par E. Rutherford, l'étudiant de Thomson, qui plus tard démontrerait l'inexactitude de ce modèle.




