Dans ses travaux à l'Université McGill au Québec, E. Rutherford utilisa les mêmes expériences de déflexion électrique et magnétique, exploitées par J.J. Thomson dans la découverte de l'électron, pour identifier les rayons alpha comme des particules positivement chargées et pour mesurer leur charge.
Rappel :
Les rayons au sens électromagnétique du terme ne sont pas sensibles à ces expériences de déflexion électrique et magnétique.
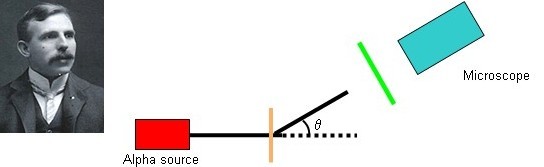
Rutherford a déterminé la déviation des trajets des particules alpha et beta, par rapport à leur direction d'incidence, en mesurant leurs images sur une plaque photographique. En effectuant ses mesures pour alpha, il a observé un effet exceptionnel : si les particules alpha avaient traversé sur leur trajet une feuille mince de mica (environ 0.003 cm d'épaisseur), leurs images sur le film étaient dispersés et barbouillés. Cependant les images étaient tranchantes si le mica n'était pas présent. Quelque chose au sujet de la feuille poussait les particules alpha à dévier à des petits angles d'une manière aléatoire.
Rutherford quitte McGill pendant l'été 1907 pour aller à l'Université de Manchester en Angleterre. Avec Hans Geiger ils continuaient à étudier le problème de déviation et de diffusion des particules alpha par des feuilles métalliques minces. En novembre 1908 il était clair pour eux que alpha est un atome d'Hélium portant deux fois la charge positive d'un électron.
Remarque :
Lors de son discours de Stockholm pour le prix Nobel en 1908, Rutherford a créée la surprise en prouvant que les particules alpha sont des atomes d'Hélium doublement chargés.
Dans cet effet de déviation de trajets, ils reconnaissaient une interaction importante entre les particules alpha et les atomes des feuilles minces, effet qui pourraient apporter plus de renseignements sur la construction de l'atome.
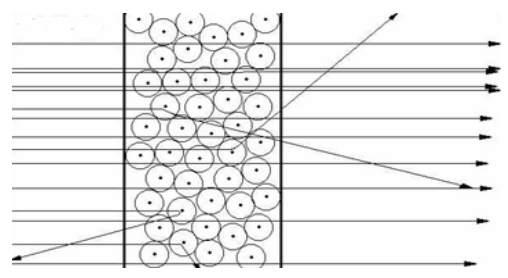
En particulier, ils bombardaient par des particules alpha (issus d'un gaz radioactif, le Radon 222), dans un vide, une feuille mince d'aluminium causant leur déviation et diffusion. Les particules diffusées étaient vues comme des scintillations ou petits éclats de lumière détectés sur un écran de
 par un microscope mobile pour effectuer des mesures autour de la feuille. On comptait le nombre de scintillations pour une durée déterminée, (environ 14 à 40 scintillations par minute) à différentes angles. L'expérience était assez difficile ; placée dans une salle sombre pour compter à l'oeil nu le nombre de scintillations pour un angle donné, elle usait la vision des deux chercheurs. Pour palier à ce problème Geiger a développé plus tard un compteur qui comptait automatiquement les scintillations, appelé le compteur de Geiger.
par un microscope mobile pour effectuer des mesures autour de la feuille. On comptait le nombre de scintillations pour une durée déterminée, (environ 14 à 40 scintillations par minute) à différentes angles. L'expérience était assez difficile ; placée dans une salle sombre pour compter à l'oeil nu le nombre de scintillations pour un angle donné, elle usait la vision des deux chercheurs. Pour palier à ce problème Geiger a développé plus tard un compteur qui comptait automatiquement les scintillations, appelé le compteur de Geiger.
L'expérience de diffusion de particules alpha par Rutherford et ses collaborateurs met fin au modèle atomique de pudding de Thomson.
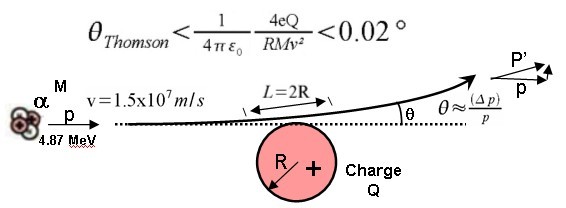
En effet, on peut démontrer qu'une charge positive distribuée d'une manière homogène dans le volume sphérique classique de l'atome ne pouvait pas dévier les particules alpha par plus qu'une petite fraction d'un degré, de l'ordre de
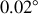 . L'expérience de Rutherford a montré des déviations d'environ
. L'expérience de Rutherford a montré des déviations d'environ
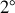 ce qui est cent fois plus important.
ce qui est cent fois plus important.
En 1909 Geiger voulait une nouvelle expérience pour un étudiant, Ernest Marsden ; Rutherford lui a suggéré que Marsden étudie les déviations des particules alpha à grands angles, et pourtant il ne pensait pas possibles ces déviations.
Mais une semaine plus tard Geiger revient voir Rutherford très enthousiasmé ; Geiger et son étudiant avaient réussit à observer des particules alpha diffusées à grand angles et chose extrêmement étonnante, certaines de ces particules paraissaient rebondir en arrière à
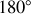 vers leur source à cause de leurs collisions avec la feuille mince d'Or ! Geiger et Marsden confirment ensuite ces résultats expérimentaux pour une série d'autres métaux, (plomb, aluminium, argent,...) en feuilles minces.
vers leur source à cause de leurs collisions avec la feuille mince d'Or ! Geiger et Marsden confirment ensuite ces résultats expérimentaux pour une série d'autres métaux, (plomb, aluminium, argent,...) en feuilles minces.
De telles déviations si importantes ne pouvaient pas être expliquées par le modèle de Thomson où la charge est distribuée d'une manière homogène dans l'atome. Afin de pouvoir expliquer l'effet, Rutherford a compris qu'il faut que toute la charge positive de l'atome soit concentrée dans un volume beaucoup plus petit que la taille de l'atome. De cette observation expérimentale est née la notion d'un noyau positivement chargé à l'intérieure de l'atome. La diffusion de l'alpha sera attribuée naturellement ainsi à l'effet d'interaction coulombienne entre la particule alpha et le noyau positivement chargé.
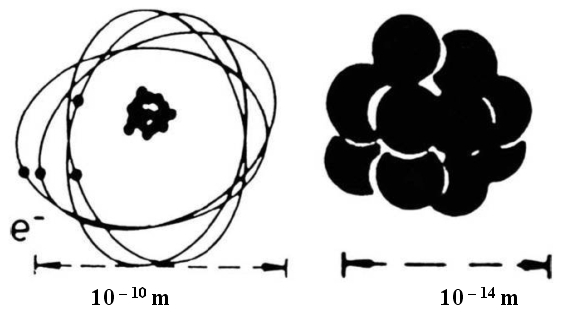
En 1911, Rutherford propose son modèle atomique. L'atome offre des espaces vides immenses. Le centre de l'atome, qu'il nomme noyau est minuscule et dense. Il est chargé positivement. Les électrons négatifs circulent autour du noyau à une très grande vitesse et se déplacent jusqu'à des distances très éloignées du noyau. La somme des charges des électrons est égale à la charge du noyau, l'atome étant électriquement neutre.
Ce modèle est au coeur de la théorie de diffusion des particules alpha par les noyaux que Rutherford a présentée en mars 1911 à Manchester et qu'il a ensuite publié comme un article en mai de la même année. (Voir le cours "Formule de la section efficace de diffusion de particules alpha" pour un calcul détaillé de la formule de Rutherford en ce qui concerne la diffusion des particules alpha par un noyau positivement chargé).
Exemple :
Pour une collision directe entre une particule alpha et le noyau d'Or qui contraint l'alpha à rebondir en arrière à
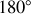 , toute l'énergie cinétique de l'alpha est convertie en énergie potentielle au point où elle change de direction ; c'est le point où elle est momentanément au repos et on peut ainsi proposer (comme Rutherford l'a fait) qu'à ce point l'énergie cinétique de la particule alpha incident est égale à son énergie potentielle dans le champ coulombien du noyau de l'Or. Posant que ce point de retournement se trouve à une distance de
, toute l'énergie cinétique de l'alpha est convertie en énergie potentielle au point où elle change de direction ; c'est le point où elle est momentanément au repos et on peut ainsi proposer (comme Rutherford l'a fait) qu'à ce point l'énergie cinétique de la particule alpha incident est égale à son énergie potentielle dans le champ coulombien du noyau de l'Or. Posant que ce point de retournement se trouve à une distance de
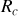 du centre du noyau ; on suppose, comme Rutherford, que
du centre du noyau ; on suppose, comme Rutherford, que
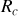 est le rayon effectif du noyau. On écrit donc que
est le rayon effectif du noyau. On écrit donc que
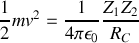
Pour la particule alpha dans une expérience typique de diffusion par le noyau de l’Or, on a :
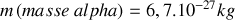 ;
;
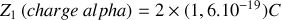 ;
;
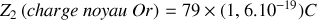 ;
;
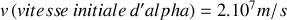 ;
;
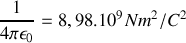 .
.
Calculer numériquement
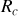 et comparer avec la valeur actuelle connue par exemple pour le rayon du noyau de l'Or. Pouvez-vous expliquer la différence ?
et comparer avec la valeur actuelle connue par exemple pour le rayon du noyau de l'Or. Pouvez-vous expliquer la différence ?




