Si la paroi et le gaz sont en équilibre thermique, ceci implique qu'en moyenne,
1) il y a autant de molécules restituées par la paroi que de molécules incidentes et de plus,
2) leurs vitesses sont réparties au hasard, de sorte que les moyennes des carrés de vitesses (incidentes ou restituées) sont égales.
La pression moyenne totale s'écrit alors :
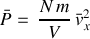
En utilisant la définition de la vitesse quadratique moyenne des molécules ainsi que la propriété d'homogénéité du gaz (les 3 directions jouent un rôle équivalent) il vient que :
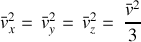
La pression cinétique se décline alors en fonction de la vitesse quadratique moyenne :
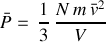
Si le gaz est parfait et qu'une mole (
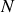 devenant alors identique au nombre d'Avogadro) est en équilibre thermique dans l'enceinte de volume
devenant alors identique au nombre d'Avogadro) est en équilibre thermique dans l'enceinte de volume
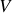 , alors la masse molaire
, alors la masse molaire
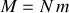 associée à la relation des gaz parfaits
associée à la relation des gaz parfaits
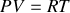 permettent de déduire la température en fonction de la vitesse quadratique moyenne :
permettent de déduire la température en fonction de la vitesse quadratique moyenne :
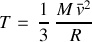
L'énergie interne du gaz s'identifie à son énergie cinétique de translation selon :
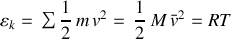
Finalement la formule reliant énergie interne du gaz
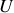 et température est obtenue :
et température est obtenue :
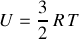 .
.




