Les potentiels thermodynamiques tels que
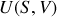 ,
,
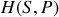 ,
,
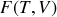 et
et
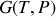 sont des ngrandeurs extensives, proportionnelles au nombre de molécules du système considéré. Tant que le système reste fermé cette dépendance au nombre de moles
sont des ngrandeurs extensives, proportionnelles au nombre de molécules du système considéré. Tant que le système reste fermé cette dépendance au nombre de moles
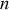 - ou à la masse
- ou à la masse
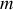 - ne modifie pas l'écriture de leurs différentielles (
- ne modifie pas l'écriture de leurs différentielles (
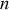 - ou
- ou
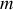 - restant constant). Ce n'est plus le cas si le système est ouvert. Le gain ou la perte éventuelle de matière par le système modifie son énergie absolue. Pour la différentielle de l'énergie interne par exemple, la dépendance à la quantité se traduit par l'équation :
- restant constant). Ce n'est plus le cas si le système est ouvert. Le gain ou la perte éventuelle de matière par le système modifie son énergie absolue. Pour la différentielle de l'énergie interne par exemple, la dépendance à la quantité se traduit par l'équation :
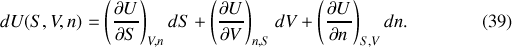
À la suite de Gibbs, on nomme « potentiel chimique »
(ou « potentiel spécifique »
si la grandeur quantitative choisie est la masse
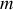 au lieu du nombre de moles
au lieu du nombre de moles
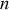 ) la troisième dérivée partielle de cette équation.
) la troisième dérivée partielle de cette équation.
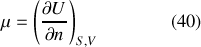
Ce potentiel chimique est une grandeur intensive, en tant que rapport de deux grandeurs différentielles extensives. La traduction analytique de l'expression (40) en fonction des variables extensives
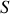 et
et
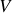 est donc nécessairement compliquée. Heureusement, il est possible d'exprimer
est donc nécessairement compliquée. Heureusement, il est possible d'exprimer
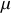 en fonction des variables intensives naturelles que sont la température et la pression.
en fonction des variables intensives naturelles que sont la température et la pression.




