Par analogie avec la définition (78) du potentiel chimique du gaz parfait, il est formellement possible de définir celui d'un corps pur quelconque par
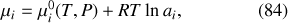
où la grandeur sans dimension
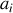 est nommée
est nommée « activité chimique »
du corps
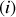 dans le mélange étudié.
dans le mélange étudié.
Dans le cas du gaz parfait, l'activité est la fraction molaire
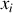 , soit le rapport
, soit le rapport
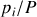 . L'expression de
. L'expression de
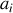 est plus délicate pour les corps réels. Les interactions électrostatiques entre espèces de molécules sont inexistantes dans le cas du mélange idéal de gaz parfaits ; elles ne le sont plus pour les mélanges de corps réels dont elles modifient l'activité chimique. Les lois de la thermodynamique macroscopique ne permettent pas un calcul direct de l'activité chimique et il faut, pour la modéliser, recourir à la thermodynamique statistique. Il est toutefois possible d'écrire formellement
est plus délicate pour les corps réels. Les interactions électrostatiques entre espèces de molécules sont inexistantes dans le cas du mélange idéal de gaz parfaits ; elles ne le sont plus pour les mélanges de corps réels dont elles modifient l'activité chimique. Les lois de la thermodynamique macroscopique ne permettent pas un calcul direct de l'activité chimique et il faut, pour la modéliser, recourir à la thermodynamique statistique. Il est toutefois possible d'écrire formellement

où le « coefficient d'activité »
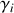 est un réel positif spécifique au corps
est un réel positif spécifique au corps
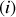 et au mélange considérés. Égal à un dans le cas du mélange idéal,
et au mélange considérés. Égal à un dans le cas du mélange idéal,
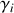 est inférieur à un dans le cas d'un mélange réel.
est inférieur à un dans le cas d'un mélange réel.
Attention :
Les conventions liées aux pratiques expérimentales conduisent à des réécritures de l'équation (84). L'activité reste généralement définie par l'équation (85) pour les solutions solides (alliages) et pour les solutions liquides si la fraction molaire
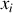 n'est ni voisine de zéro, ni voisine de un.
n'est ni voisine de zéro, ni voisine de un.
Pour les gaz et solutions liquides diluées, en revanche, recours est fait, respectivement, à des pression
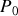 et concentration
et concentration
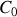 de référence, toutes deux exprimées dans les unités de travail. Ces modifications n'entraînent que de légères redéfinitions des potentiels de référence
de référence, toutes deux exprimées dans les unités de travail. Ces modifications n'entraînent que de légères redéfinitions des potentiels de référence
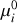 .
.
Pour les gaz, l'activité
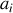 est généralement définie par le produit
est généralement définie par le produit
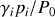 , soit
, soit
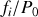 , où
, où
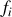 est la
est la « fugacité »
du gaz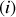 . Le potentiel chimique s'exprime alors de façon similaire à la formulation (80) du potentiel chimique du gaz parfait
. Le potentiel chimique s'exprime alors de façon similaire à la formulation (80) du potentiel chimique du gaz parfait
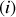 :
:
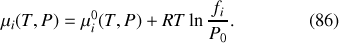
Pour les solutions liquides diluées,
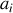 est égal au rapport
est égal au rapport
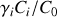 , où
, où
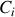 désigne la concentration de l'espèce
désigne la concentration de l'espèce
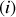 dans la solution et la concentration de référence
dans la solution et la concentration de référence
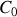 (en général
(en général
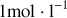 ) est écrite dans la même unité de mesure que
) est écrite dans la même unité de mesure que
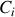 .
.
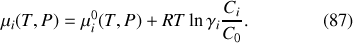
Remarque :
Si la fraction molaire du corps réel est très faible ou au contraire proche de un, le coefficient d'activité tend vers un. Aussi,
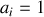 pour les solides et liquides purs et les précipités en phase solide d'une solution ;
pour les solides et liquides purs et les précipités en phase solide d'une solution ;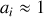 pour les solvants liquides dans le cas où le soluté est en quantité négligeable ;
pour les solvants liquides dans le cas où le soluté est en quantité négligeable ;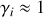 pour les gaz en faible concentration et les solutions très diluées.
pour les gaz en faible concentration et les solutions très diluées.




