Un « état »
ou « phase »
d'un corps est un mode particulier d'organisation de la matière, qui n'est possible que dans des conditions particulières de température
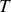 et de pression
et de pression
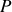 . Lorsque ces conditions varient, un corps est susceptible de changer d'état, d'effectuer une
. Lorsque ces conditions varient, un corps est susceptible de changer d'état, d'effectuer une « transition de phase »
. Pour les corps purs à pression constante, il existe une température unique de transition entre deux phases données.
Les états solide, liquide et gazeux (ou vapeur) correspondent à trois niveaux d'organisation de la matière :
ordre à grande distance pour les cristaux solides ;
ordre à courte distance pour les solides amorphes et les liquides ;
désordre pour les gaz (rappelons que le mot gaz vient du grec
« khaos »
par l'intermédiaire du néerlandais).
Toutefois, à l'intérieur même des phases condensées (solide ou liquide) il existe plusieurs types d'organisation des atomes ou molécules. Les cristaux solides possèdent en général plusieurs phases en fonction de
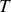 et
et
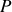 . Les cristaux liquides, intermédiaires entre les phases solide et liquide (d'où leur nom de
. Les cristaux liquides, intermédiaires entre les phases solide et liquide (d'où leur nom de « mésophases »
) caractérisent un ordre partiel (généralement d'orientation ou d'empilement) de certaines molécules, qui rend le liquide anisotrope. A l'état liquide, a fortiori gazeux, le désordre d'orientation et de position rend au contraire le fluide isotrope.
Le potentiel chimique permet d'accéder à des informations essentielles sur l'état d'une espèce donnée : stabilité ou instabilité, thermodynamique de l'éventuelle transition de phase. Afin de le bien comprendre, considérons un système enfermé dans un récipient rigide (de volume constant) où deux phases (
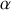 ) et (
) et (
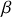 ) d'une même espèce chimique coexistent à l'équilibre (par exemple, liquide et vapeur). La différentielle de l'énergie interne de la phase (
) d'une même espèce chimique coexistent à l'équilibre (par exemple, liquide et vapeur). La différentielle de l'énergie interne de la phase (
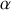 ) peut être exprimée sous la forme :
) peut être exprimée sous la forme :
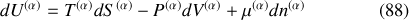
De plus, le sytème étant fermé, rigide et à l'équilibre, les quantités
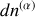 ,
,
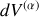 et
et
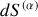 sont, respectivement, égales en modules et opposées en signe aux quantités
sont, respectivement, égales en modules et opposées en signe aux quantités
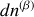 ,
,
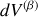 et
et
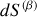 de la phase (
de la phase (
 ). La différentielle de l'énergie interne de la réunion des deux phases peut donc être écrite sous la forme :
). La différentielle de l'énergie interne de la réunion des deux phases peut donc être écrite sous la forme :
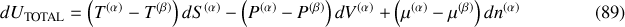
Or, à l'équilibre, le potentiel thermodynamique
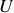 est minimal. Ses dérivées partielles doivent être nulles, en particulier ses dérivées partielles par rapport à
est minimal. Ses dérivées partielles doivent être nulles, en particulier ses dérivées partielles par rapport à
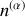 ,
,
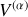 et
et
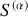 . Par suite :
. Par suite :
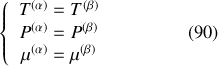
Conclusion
Lorsque deux phases coexistent à l'équilibre, leurs températures, pressions et potentiels chimiques (ou spécifiques) sont égaux (ce résultat est généralisable à trois phases -ou plus- coexistant à l'équilibre).
Supposons maintenant que les températures et pressions des deux phases soient égales, mais pas les potentiels chimiques. Dans ce cas, le système n'est pas à l'équilibre et l'évolution spontanée vers l'équilibre s'accompagne nécessairement d'une diminution de l'énergie interne (U étant minimale à l'équilibre).
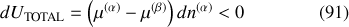
Ou bien
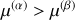 et
et
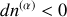 , ou bien
, ou bien
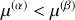 et
et
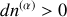 . Dans les deux cas le nombre de moles qui augmente est celui de la phase dont le potentiel chimique est le plus bas.
. Dans les deux cas le nombre de moles qui augmente est celui de la phase dont le potentiel chimique est le plus bas.
Conclusion
La phase d'équilibre stable est celle dont le potentiel chimique est le plus bas. La matière tend à s'organiser dans la phase dont le potentiel chimique est le plus bas.
Pour autant, il arrive que deux phases coexistent de façon apparemment stable alors que leurs potentiels chimiques ne sont pas égaux. Un tel pseudo-équilibre « métastable »
peut survenir si le potentiel thermodynamique comporte un minimum local, comme l'illustre la figure 6.
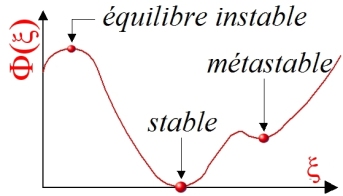
Le fond du puits local est alors plus élevé que celui de l'équilibre thermodynamique mais le système peut y rester bloqué tant que les fluctuations des paramètres d'état ne suffisent pas à l'en faire sortir. C'est ce qui explique, par exemple, que des cristaux de carbone subsistent en phase diamant dans les conditions ambiantes de température et de pression alors que la phase stable y est le graphite.




