De par l'expression générale du potentiel chimique donnée par l'équation (84),
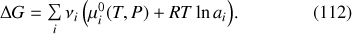
En définissant une « enthalpie libre standard de réaction »
,
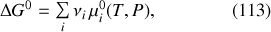
et une « constante d'équilibre »
sans dimension liée aux activités
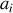 des différentes espèces en jeu dans la réaction chimique et aux coefficients stœchiométriques algébriques
des différentes espèces en jeu dans la réaction chimique et aux coefficients stœchiométriques algébriques
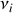 ,
,

l'équation (112) peut être réécrite sous la forme :
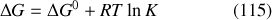
À l'équilibre chimique,
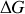 est nul et il devient possible de relier les activités chimiques, c'est à dire la constante d'équilibre, aux potentiels chimiques standards. C'est la
est nul et il devient possible de relier les activités chimiques, c'est à dire la constante d'équilibre, aux potentiels chimiques standards. C'est la « loi d'action de masse »
formulée pour la première fois en 1867 par les Norvégiens Cato Guldberg et Peter Waage :
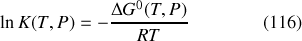
Remarque :
En dépit de son nom, la « constante »
d'équilibre est une fonction de la pression et, surtout, de la température. Elle est néanmoins indépendante des quantités des différentes espèces.
Exemple : L'équilibre entre gaz parfaits
Supposons que les acteurs de la réaction (105) puissent tous être considérés comme des gaz parfaits. Si l'on adopte l'écriture du potentiel chimique du gaz parfait donnée par l'équation (80) et une pression de référence égale à une atmosphère (
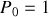 ), alors les activités des gaz sont égales à leurs pressions partielles
), alors les activités des gaz sont égales à leurs pressions partielles
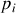 données en atmosphères. Pour l'illustrer, considérons le dioxyde de soufre SO
données en atmosphères. Pour l'illustrer, considérons le dioxyde de soufre SO
 , partiellement oxydé par le dioxygène O
, partiellement oxydé par le dioxygène O
 en trioxyde de soufre SO
en trioxyde de soufre SO
 . Les coefficients stoechiométriques associés à ces trois espèces sont respectivement
. Les coefficients stoechiométriques associés à ces trois espèces sont respectivement
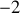 ,
,
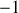 et 2.
et 2.
La loi d'action de masse s'écrit dans ce cas :
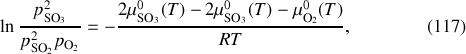
où il apparaît clairement que le rapport de transformation de SO
 en SO
en SO
 est fonction de la température.
est fonction de la température.
Remarque :
Si au contact des gaz intervient dans la réaction une espèce en phase condensée, l'activité de celle-ci est égale à l'unité et n'influe pas sur la valeur de la constante
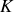 . En revanche, le potentiel chimique de cette espèce continue à déterminer en partie l'expression de
. En revanche, le potentiel chimique de cette espèce continue à déterminer en partie l'expression de
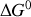 .
.
Pour une réaction intervenant dans une solution diluée, seules les activités des espèces diluées influent sur la constante d'équilibre (les autres activités étant égales à l'unité).




