Le nombre
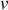 de paramètres d'état indépendants d'un système est nommé
de paramètres d'état indépendants d'un système est nommé « variance »
. Il est égal au nombre
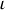 de paramètres intensifs du système diminué du nombre
de paramètres intensifs du système diminué du nombre
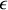 d'équations d'état indépendantes qui relient entre eux ces paramètres.
d'équations d'état indépendantes qui relient entre eux ces paramètres.
Pour un corps pur existant dans une phase donnée, il y a trois paramètres d'état intensifs :
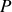 ,
,
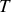 et le volume molaire
et le volume molaire
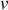 . L'équation d'état du corps permet d'exprimer l'un de ces trois paramètres en fonction des deux autres (pour un gaz parfait, par exemple,
. L'équation d'état du corps permet d'exprimer l'un de ces trois paramètres en fonction des deux autres (pour un gaz parfait, par exemple,
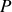 est égal à
est égal à
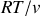 ). Or, c'est la seule équation reliant les trois paramètres. Une phase donnée d'un corps pur a donc deux paramètres d'état indépendants.
). Or, c'est la seule équation reliant les trois paramètres. Une phase donnée d'un corps pur a donc deux paramètres d'état indépendants.
Lorsque
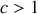 corps purs et/ou
corps purs et/ou
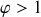 phases coexistent au sein d'un même système fermé, la variance ne peut plus se résumer aux deux paramètres d'état indépendants d'une phase unique de corps pur. Toutefois, la variance peut être exprimée en fonction de
phases coexistent au sein d'un même système fermé, la variance ne peut plus se résumer aux deux paramètres d'état indépendants d'une phase unique de corps pur. Toutefois, la variance peut être exprimée en fonction de
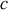 et
et
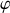 .
.
Calculons dans un premier temps le nombre
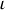 de paramètres intensifs en fonction de
de paramètres intensifs en fonction de
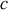 et
et
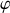 . Une quantité molaire
. Une quantité molaire
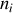 (ou massique
(ou massique
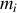 ) de molécules caractérise la présence d'un corps pur
) de molécules caractérise la présence d'un corps pur
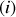 . De même, une quantité
. De même, une quantité
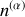 (ou
(ou
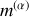 ) de molécules signe l'existence d'une phase (
) de molécules signe l'existence d'une phase (
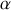 ). Prenant le rôle que joue le volume molaire dans le cas du corps pur, la fraction molaire (ou massique)
). Prenant le rôle que joue le volume molaire dans le cas du corps pur, la fraction molaire (ou massique)
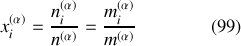
est un paramètre intensif qui définit la proportion du constituant
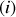 en phase (
en phase (
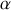 ) relativement à la quantité de matière existant en phase (
) relativement à la quantité de matière existant en phase (
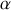 ). Il existe en tout
). Il existe en tout
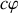 fractions molaires, puisqu'il existe
fractions molaires, puisqu'il existe
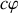 manières de grouper les
manières de grouper les
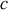 indices
indices
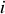 et les
et les
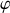 superindices (
superindices (
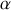 ). Il faut ajouter à ce nombre celui des deux paramètres intensifs extérieurs indépendants
). Il faut ajouter à ce nombre celui des deux paramètres intensifs extérieurs indépendants
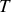 et
et
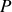 qui déterminent l'état de tous les corps purs
qui déterminent l'état de tous les corps purs
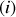 en phase (
en phase (
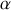 ). En effet, les températures et pressions des divers corps et des diverses phases sont toutes égales à l'équilibre. Par suite :
). En effet, les températures et pressions des divers corps et des diverses phases sont toutes égales à l'équilibre. Par suite :

Considérons dans un second temps le nombre
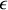 d'équations reliant les paramètres d'état en fonction de
d'équations reliant les paramètres d'état en fonction de
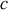 et
et
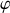 . À l'équilibre du système, pour chaque constituant, il y a égalité des potentiels chimiques caractérisant une phase (
. À l'équilibre du système, pour chaque constituant, il y a égalité des potentiels chimiques caractérisant une phase (
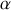 ) pour chaque constituant
) pour chaque constituant
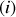 . On a donc
. On a donc
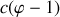 égalités du type :
égalités du type :
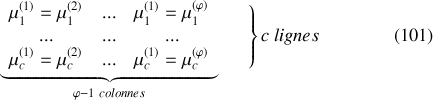
De plus, pour chaque phase (
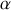 ), il est possible d'exprimer une fraction molaire de constituant (par exemple le constituant
), il est possible d'exprimer une fraction molaire de constituant (par exemple le constituant
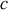 ) en fonction des
) en fonction des
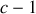 autres car
autres car
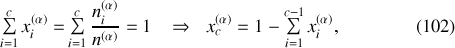
et il existe
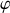 égalités de ce dernier type. Le nombre total d'équations est donc :
égalités de ce dernier type. Le nombre total d'équations est donc :
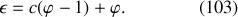
La variance étant égale à la différence entre
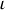 et
et
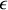 , on en déduit immédiatement la
, on en déduit immédiatement la « règle des phases »
établie en 1876 par Willard Gibbs :
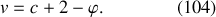
Pour les corps purs (
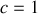 ), cette règle des phases permet de :
), cette règle des phases permet de :
retrouver la divariance (
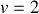 ) constatée pour la phase homogène (
) constatée pour la phase homogène (
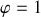 ) ;
) ;prévoir que la coexistence de deux phases (
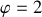 ) à l'équilibre définit un système monovariant (
) à l'équilibre définit un système monovariant (
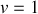 ) où la température (de transition de phase) dépend de la pression et dessine une courbe (dite de
) où la température (de transition de phase) dépend de la pression et dessine une courbe (dite de « pression saturante »
) dans un espace (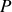 ,
,
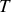 ) ;
) ;deviner qu'il existe dans ce même espace (
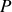 ,
,
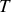 ) un point triple (
) un point triple (
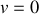 ) où les trois phases solide, liquide et vapeur coexistent.
) où les trois phases solide, liquide et vapeur coexistent.
Mais c'est pour les mélanges de plusieurs corps que la règle des phases est la plus utile.
Remarque :
La règle de Gibbs connaît certaines limites. Si le système possède des propriétés électriques ou magnétiques, le champ électrique ou magnétique doit être compté parmi les paramètres intensifs extérieurs et la variance doit augmenter d'une unité. Si une réaction chimique est à l'oeuvre, une relation supplémentaire doit être prise en compte et la variance diminue d'une unité.




