Intéressons-nous maintenant aux réactions et équilibres chimiques. Soient Ai les espèces impliquées dans une réaction et
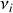 les coefficients stoechiométriques associés. Par convention, ceux-ci sont algébriques et comptés positivement si l'espèce est produite, négativement si elle disparaît. Ainsi peut-on écrire toute réaction chimique sous la forme :
les coefficients stoechiométriques associés. Par convention, ceux-ci sont algébriques et comptés positivement si l'espèce est produite, négativement si elle disparaît. Ainsi peut-on écrire toute réaction chimique sous la forme :

Le nombre de moles
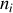 étant celui de l'espèce
étant celui de l'espèce
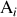 , sa variation éventuelle
, sa variation éventuelle
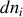 est nécessairement liée à un certain
est nécessairement liée à un certain « degré d'avancement de la réaction »
sans dimension
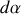 tel que :
tel que :

Dans l'hypothèse où les espèces sont en équilibre thermique (
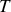 ), mécanique (
), mécanique (
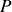 ) et physique (potentiels chimiques égaux), il est possible d'obtenir l'équilibre chimique (stabilité de chaque quantité
) et physique (potentiels chimiques égaux), il est possible d'obtenir l'équilibre chimique (stabilité de chaque quantité
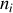 ). Il faut pour cela que l'enthalpie libre du système soit minimale :
). Il faut pour cela que l'enthalpie libre du système soit minimale :
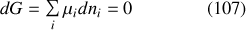
Compte tenu de l'équation (106), cela revient à écrire la relation supplémentaire (qui réduit d'une unité la variance du système) :
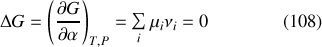
où
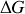 est l'enthalpie libre de réaction. Son opposée, la grandeur
est l'enthalpie libre de réaction. Son opposée, la grandeur
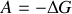 , est nommée
, est nommée « affinité chimique »
de la réaction.
Très souvent cependant, l'équilibre chimique n'est pas réalisé et la différentielle
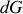 est négative (l'enthalpie libre du système tendant vers un minimum). Si l'enthalpie libre de réaction
est négative (l'enthalpie libre du système tendant vers un minimum). Si l'enthalpie libre de réaction
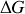 est négative, l'affinité
est négative, l'affinité
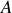 et le degré d'avancement
et le degré d'avancement
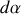 sont positifs. Si elle est positive,
sont positifs. Si elle est positive,
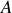 et
et
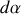 sont négatifs. L'évolution, qui se poursuit jusqu'à ce que
sont négatifs. L'évolution, qui se poursuit jusqu'à ce que
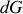 soit nulle, s'accompagne d'un échange d'énergie par chaleur entre le système et l'extérieur, soit par absorption (réaction endothermique) soit par dégagement (réaction exothermique). À pression constante, cet échange est égal à la variation d'enthalpie du système. Or, d'après la seconde relation de Gibbs-Helmholtz (27), la différentielle
soit nulle, s'accompagne d'un échange d'énergie par chaleur entre le système et l'extérieur, soit par absorption (réaction endothermique) soit par dégagement (réaction exothermique). À pression constante, cet échange est égal à la variation d'enthalpie du système. Or, d'après la seconde relation de Gibbs-Helmholtz (27), la différentielle
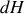 s'exprime sous la forme :
s'exprime sous la forme :
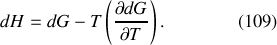
Au voisinage de l'équilibre,
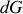 peut être considérée comme nulle. Par dérivation de l'équation (107), il vient par ailleurs :
peut être considérée comme nulle. Par dérivation de l'équation (107), il vient par ailleurs :
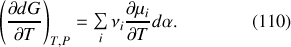
En conséquence, l'enthalpie de réaction à pression constante est donnée relativement au degré d'avancement de la réaction par :
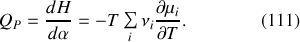
Le signe et la grandeur du transfert thermique thermique apparaissent directement liés à la dépendance en température des potentiels chimiques des espèces impliquées dans la réaction.




