Considérons un bloc de glace à une température initiale inférieure à 0°C. Si un flux thermique constant lui est appliqué, sa température s'élève à peu près linéairement jusqu'à 0°C. Alors, la glace commence à fondre. Mais, tant que cette transition vers l'état liquide n'est pas achevée, sa température reste 0°C. De même, l'eau liquide parvenue à 100°C reste en ébullition à cette température tant que la transition vers l'état vapeur n'est pas terminée. Il apparaît que ces transitions de phase d'un corps pur sont des processus isothermes réversibles qui nécessitent l'échange par chaleur à pression constante d'une certaine quantité d'énergie entre le corps considéré et le milieu extérieur. De telles quantités d'énergie sont nommées « enthalpies de changement d'état »
(de fusion, de vaporisation, etc.) (5). Elles dépendent de la température de transition de phase (c'est à dire de la pression, le corps pur étant alors monovariant).
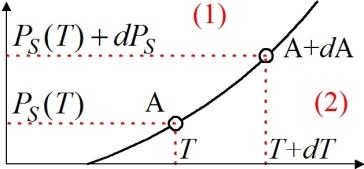
Pour déterminer l'enthalpie de changement d'état, considérons une courbe de pression saturante
 , lieu d'équilibre entre deux phases (1) et (2), et deux points infiniment voisins de cette courbe, A et A+dA. L'égalité des potentiels chimiques étant vérifiée sur la courbe de pression saturante, elle l'est en A et en A+dA.
, lieu d'équilibre entre deux phases (1) et (2), et deux points infiniment voisins de cette courbe, A et A+dA. L'égalité des potentiels chimiques étant vérifiée sur la courbe de pression saturante, elle l'est en A et en A+dA.
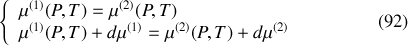
Par suite, l'égalité des potentiels est également vérifiée par leurs différentielles sur la courbe de pression saturante :
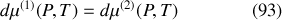
Or, la différentielle
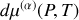 du potentiel chimique d'un corps en phase (
du potentiel chimique d'un corps en phase (
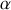 ) s'écrit :
) s'écrit :
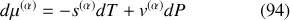
Par suite, sur la courbe de pression saturante,
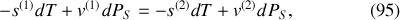
et il vient :
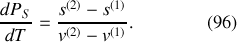
La variation d'entropie lors d'une transformation isotherme est égale au rapport à la température de l'énergie échangée par chaleur. Ici, le transfert thermique nécessaire au changement de phase (1)
 (2) est l'enthalpie
(2) est l'enthalpie
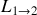 :
:
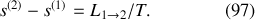
Émerge finalement la « formule de Clapeyron »
,
qui quantifie l'enthalpie molaire (ou massique) de changement d'état en fonction de la température, de la pente de la courbe
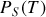 , et de la variation de volume molaire (ou massique) lors de la transition de phase. Cette dernière variation est la différence entre le volume molaire (ou massique) de la phase finale (2) à l'état saturant et le volume molaire (ou massique) de la phase initiale (1) à l'état saturant (pour la température de transition).
, et de la variation de volume molaire (ou massique) lors de la transition de phase. Cette dernière variation est la différence entre le volume molaire (ou massique) de la phase finale (2) à l'état saturant et le volume molaire (ou massique) de la phase initiale (1) à l'état saturant (pour la température de transition).




