On parle de gaz réel lorsqu'il y a des interactions entre les molécules le constituant (collisions...). Les gaz réels se rapprochent des gaz parfaits quand on se rapproche des faibles densités car les interactions entre molécules sont plus faibles ; cependant, sans collisions, on peut remarquer que toutes les hypothèses de la physique statistique sont fausses, car il n'y aurait pas alors d'évolution vers l'équilibre par échange de quantité de mouvement entre molécules ou atomes, ou d'ergodicité permettant de calculer des moyennes macroscopiques en considérant les positions et vitesses comme aléatoires et explorant tout l'espace des phases autorisé, donc d'égalité des moyennes spatiales sur l'espace des phases et des moyennes temporelles.
Du point de vue macroscopique une déviation à la loi des gaz parfaits se développe :
avec des corrections ![]() .
.
Au premier ordre cette équation peut se réécrire :
avec ![]() .
.
Au second ordre , ce développement peut coïncider avec celui de l'équation de Van der Waal :
à haute température : ![]()
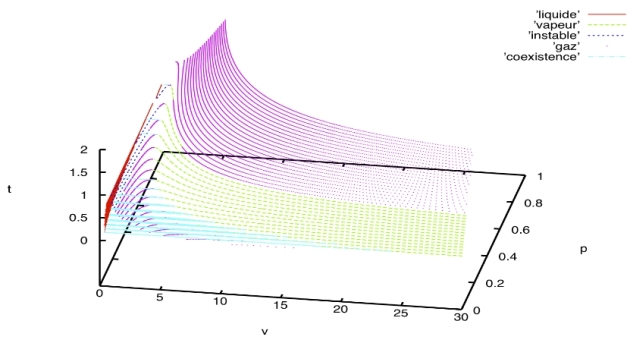
* Représentation tridimensionnelle des courbes P,V,T régies par l'équation de Van der Waals adimensionnée (exprimée en fonction des volumes, pressions et températures critiques). A haute température on retrouve des courbes proches du gaz parfait, en dessous du point critique on a cependant une coexistence entre liquide et vapeur au vu du caractère instable des courbes. Cette coexistence est calculable par la « construction de Maxwell »
.