Cliquez ici pour revoir la définition de l'isotopie
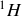
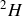
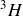 sont trois isotopes de l'hydrogène.
sont trois isotopes de l'hydrogène.
Le noyau d'hydrogène 1, ou « hydrogène léger », est constitué d'un seul proton. | Noyau d'hydrogène 1 |
Le noyau d'hydrogène 2, c'est-à-dire le noyau de deutérium (appelé deuton) ou « hydrogène lourd », contient 1 proton et 1 neutron. | Noyau d'hydrogène 2 |
Le noyau d'hydrogène 3, c'est-à-dire le noyau de tritium (appelé triton) contient 1 proton et 2 neutrons. |  Noyau d'hydrogène 3 |
Abondance isotopique : l'hydrogène naturel est composé essentiellement d'hydrogène 1 à 99,985% contre 0,015% de deutérium.
Remarque :
Seuls l'hydrogène 1 et le deutérium sont des isotopes stables de l'hydrogène. Le tritium est radioactif.
Comme nous l'avons dit, les abondances isotopiques sont des pourcentages donnés en nombre d'atomes et non en masse.




