Cliquez ici pour revoir la définition de l'isotopie
Le carbone 12, le carbone 13 et le carbone 14, respectivement notés
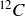
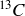
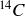 sont trois isotopes du carbone présents naturellement sur Terre.
sont trois isotopes du carbone présents naturellement sur Terre.
Ces nucléides contiennent tous les trois 6 protons, mais possèdent respectivement 6, 7 et 8 neutrons.
Abondance isotopique : le carbone naturel est composé de 98,9% de carbone 12 et de 1,1% de carbone 13. Le carbone 14 est présent en très infime quantité (de l'ordre de 1 noyau de carbone 14 pour
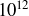 noyaux de carbone) de sorte qu'en pratique, on ne le prend pas en compte dans le calcul de l'abondance naturelle.
noyaux de carbone) de sorte qu'en pratique, on ne le prend pas en compte dans le calcul de l'abondance naturelle.
Remarque : Remarque sur le tableau de Mendeleïev :
Le tableau périodique des éléments (tableau de Mendeleïev) recense les éléments chimiques. Ils sont classée chacun dans une case par valeurs croissantes de Z (on rappelle que c'est la valeur de Z qui caractérise chaque élément chimique). Les différents isotopes d'un même élément ne sont donc pas représentés dans le tableau de Mendeleïev. Par exemple, une seule case est réservée à l'élément l'hydrogène (
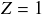 ) alors qu'il est formé de deux isotopes dans la nature. De même pour l'élément carbone (
) alors qu'il est formé de deux isotopes dans la nature. De même pour l'élément carbone (
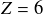 ). Le calcul de la masse molaire de chaque élément prend en revanche en compte la composition isotopique de cet élément.
). Le calcul de la masse molaire de chaque élément prend en revanche en compte la composition isotopique de cet élément.
Exemple :
La masse molaire du carbone 12 est de 12 g/mol.
La masse molaire de l'élément carbone reportée dans le tableau de Mendeleiv est celle du carbone naturel et vaut 12,011 g/mol. Elle prend en compte la composition isotopique en carbone 12 et carbone 13 de cet élément.




