Cliquez ici pour revoir la définition de l'isotopie
Le chlore naturel possède deux isotopes, le chlore 35 et le chlore 37.
Ces isotopes possèdent 17 protons et respectivement 18 neutrons pour le chlore 35 et 20 neutrons pour le chlore 37.
Abondance isotopique : le chlore naturel est composé d'environ 76% de chlore 35 et 24% de chlore 37, ce qui explique que sa masse molaire soit d'environ
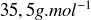 .
.
Remarque :
La découverte des isotopes a levé le voile sur un « mystère » du point de vue de l'Histoire de la Physique et de la Chimie. En effet les atomes étant composé d'un nombre entier de ce que l'on appelle aujourd'hui les nucléons, on s'attendait à obtenir pour tous les éléments chimiques une masse molaire approximativement entière elle aussi. Avec une masse molaire de 35,5 g/mol, le chlore notamment constituait une exception à cette « règle » dont on ne comprenait pas l'explication. C'est le fait que l'élément chlore possède deux isotopes naturels qui est la clef du mystère.




