L'atome de carbone 12 étant composé de 12 nucléons (6 protons et 6 neutrons), on peut conclure de la définition de l'unité de masse atomique que 1 uma représente la masse moyenne d'un nucléon (proton ou neutron) dans le carbone 12 (en négligeant en première approximation la masse des 6 électrons de cet atome).
Expérimentalement, on obtient que la masse du proton est égale à :
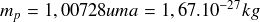
La masse du neutron est :
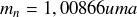
Le neutron est donc légèrement plus lourd que le proton.
Les valeurs des masse du proton et du neutron sont donc effectivement très proches de 1 uma. Cependant, on peut d'ores et déjà noter un paradoxe : si on prend la valeur moyenne des masses du proton et du neutron, on voit que l'on obtient une valeur supérieure à 1 uma, contrairement à ce que l'on attendait de la définition ci-dessus. Nous verrons comment s'explique ce paradoxe dans la partie « Nucléon libre, nucléon lié » .




