
Pour toute transformation quasi-statique d'un système
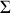 échangeant par chaleur avec le monde extérieur
échangeant par chaleur avec le monde extérieur
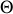 la quantité d'énergie
la quantité d'énergie
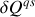 , il est loisible d'exprimer la variation différentielle d'entropie de l'Univers i.e. la somme des variations d'entropie de
, il est loisible d'exprimer la variation différentielle d'entropie de l'Univers i.e. la somme des variations d'entropie de
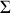 et de
et de
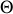 :
:
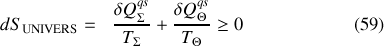
Or, l'énergie perdue ou gagnée par chaleur par l'extérieur (la "source thermique'') est l'opposée de celle gagnée ou perdue par le système :

Par suite, la variation différentielle d'entropie de l'Univers peut s'écrire :
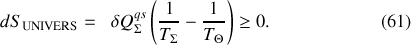
La réversibilité d'une transformation correspondant à une variation nulle de l'entropie de l'Univers, l'équation (61) montre que la réversibilité mécanique et thermique ne peut être atteinte que pour deux transformations différentielles quasi-statiques particulières :
lorsqu'il n'y a pas d'échange thermique (
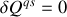 )
)lorsque l'échange thermique a lieu à la même température pour le système et pour le monde extérieur (
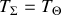 ).
).
Le résultat est identique si, au lieu d'une transformation différentielle, c'est une transformation intégrale qui est considérée. Celle-ci est réversible si elle est adiabatique quasi-statique (
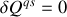 en permanence et
en permanence et
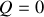 ) ou si l'échange thermique est tel que, tout au long du chemin suivi, le système et la source thermique restent à des températures égales de part et d'autre (
) ou si l'échange thermique est tel que, tout au long du chemin suivi, le système et la source thermique restent à des températures égales de part et d'autre (
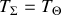 ). Dans le cas important où la source thermique est un thermostat, l'échange thermique est réversible (
). Dans le cas important où la source thermique est un thermostat, l'échange thermique est réversible (
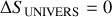 ) si et seulement s'il est isotherme.
) si et seulement s'il est isotherme.
L'inéquation contenue dans (61) montre en outre que si la température du système est plus grande que celle de la source (
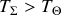 ) alors le transfert thermique doit se faire du système de référence vers la source (
) alors le transfert thermique doit se faire du système de référence vers la source (
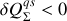 ). Réciproquement, si elle est plus petite (
). Réciproquement, si elle est plus petite (
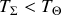 ) alors le transfert doit se faire vers le système (
) alors le transfert doit se faire vers le système (
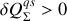 ). Dans les deux cas, le plus chaud perd de l'énergie par chaleur au profit du plus froid. Le second principe est équivalent au postulat "l''essence de la chaleur [est de] passer des corps chauds aux corps froids'' utilisé par Clausius en 1850 pour démontrer le principe de Carnot.
). Dans les deux cas, le plus chaud perd de l'énergie par chaleur au profit du plus froid. Le second principe est équivalent au postulat "l''essence de la chaleur [est de] passer des corps chauds aux corps froids'' utilisé par Clausius en 1850 pour démontrer le principe de Carnot.
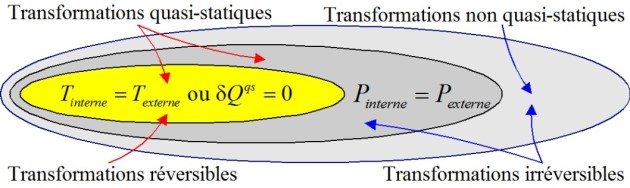
En résumé
un échange d'énergie par travail est mécaniquement réversible (quasi-statique) si la pression intérieure au système et la pression extérieure restent égales au cours de la transformation;
une transformation quasi-statique purement mécanique (adiabatique) est thermiquement réversible, donc réversible;
un échange quasi-statique d'énergie par chaleur est thermiquement réversible, donc réversible, si températures interne et externe au système restent égales au cours de la transformation;
une transformation est réversible si elle est réversible mécaniquement et thermiquement; cela ne se produit qu'en l' absence de chocs et de discontinuités mécaniques ou thermiques.
Remarque :
Une transformation adiabatique quasi-statique est nécessairement isentropique et ne modifie pas l'entropie de l'Univers. "Quasi-statique'' et "réversible'' sont ici rigoureusement équivalents. Cependant, si une adiabatique réversible est isentropique, une isentropique n'est pas obligatoirement adiabatique. Un système peut en effet revenir à son entropie initiale après variation de son entropie au cours de la transformation. Celle-ci est alors isentropique mais pas adiabatique quasi-statique.




