Exemple : n°1
Considérons à nouveau l'interaction thermique entre deux corps A et B séparés par une cloison rigide et diatherme, et isolés du milieu extérieur.

Soient
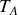 et
et
 ,
,
 et
et
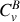 les températures initiales et les capacités thermiques de A et B, respectivement. Soit
les températures initiales et les capacités thermiques de A et B, respectivement. Soit
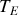 la température du système A+B à l'équilibre thermique. Comme les volumes A et B ne varient pas, les variations d'énergie interne et d'entropie de A et B ne dépendent que des variations de température. Que X désigne A ou B, il vient :
la température du système A+B à l'équilibre thermique. Comme les volumes A et B ne varient pas, les variations d'énergie interne et d'entropie de A et B ne dépendent que des variations de température. Que X désigne A ou B, il vient :

Le système A+B étant isolé, son énergie interne se conserve :
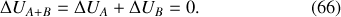
De la résolution de cette équation découle une température d'équilibre
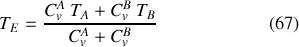
qui constitue le barycentre des températures affectées des "masses'' que sont les capacités thermiques des deux corps A et B et permet de calculer la variation d'entropie du système A+B, soit celle de l'Univers :
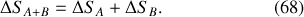
Dans le cas particulier où les deux corps ont une même capacité thermique
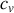 , il vient :
, il vient :

et une variation d'entropie de l'Univers simplement égale à :
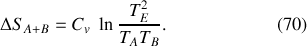
Après utilisation de l'identité remarquable
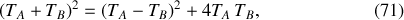
il apparaît que la variation d'entropie de l'Univers se présente sous la forme explicitement positive (ou nulle dans le cas trivial où les températures initiales
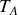 et
et
 sont égales)
sont égales)
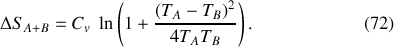
Cela confirme que l'interaction thermique entre deux systèmes à des températures distinctes est nécessairement irréversible. Aisément généralisable, cet exemple permet de mieux comprendre pourquoi un système isolé initialement en déséquilibre thermique va évoluer à la fois vers une température barycentrique uniforme et une entropie maximale. Il suffit pour cela de le diviser par la pensée en petits sous-systèmes, de températures quasi-uniformes mais distinctes.
Exemple : n°2
Considérons un thermostat
 (système de très capacité thermique susceptible d'échanger de l'énergie par chaleur sans que sa température n'en soit affectée) et le système
(système de très capacité thermique susceptible d'échanger de l'énergie par chaleur sans que sa température n'en soit affectée) et le système
 de capacité thermique
de capacité thermique
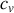 .
.
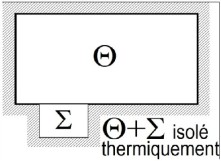
Dès lors que le système
 interagit thermiquement avec le thermostat
interagit thermiquement avec le thermostat
 , sa température évolue à partir d'une valeur initiale
, sa température évolue à partir d'une valeur initiale
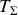 jusqu'à la température
jusqu'à la température
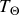 du thermostat. De plus, l'ensemble formé par le thermostat
du thermostat. De plus, l'ensemble formé par le thermostat
 et le système
et le système
 étant isolé thermiquement, les quantités d'énergie échangées par chaleur se compensent :
étant isolé thermiquement, les quantités d'énergie échangées par chaleur se compensent :

Les variations d'énergie interne et d'entropie du thermostat sont :
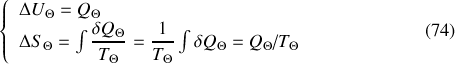
ce qui, en fonction de l'égalité (73) peut être réécrit sous la forme :
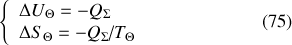
Le système
 n'échangeant pas de travail avec un opérateur extérieur à l'ensemble (
n'échangeant pas de travail avec un opérateur extérieur à l'ensemble (
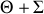 ),
),

Les variations d'entropie de
 et du thermostat
et du thermostat
 sont respectivement :
sont respectivement :
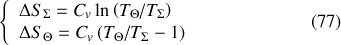
La variation d'entropie de l'Univers due à l'interaction thermique est par conséquent :

Or, il est aisé de démontrer que la fonction
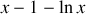 est strictement positive, sauf en
est strictement positive, sauf en
 où elle est nulle. Ce cas particulier correspond à la situation triviale où le système est initialement déjà à la température du thermostat. Dans le cas plus intéressant où
où elle est nulle. Ce cas particulier correspond à la situation triviale où le système est initialement déjà à la température du thermostat. Dans le cas plus intéressant où
 et
et
 ne sont pas initialement à la même température, l'entropie de l'Univers augmente, ce qui correspond à nouveau à une interaction thermique irréversible.
ne sont pas initialement à la même température, l'entropie de l'Univers augmente, ce qui correspond à nouveau à une interaction thermique irréversible.
Exemple : n°3
Hormis le fait de présenter le calcul de la variation d'entropie d'un thermostat idéal, l'exemple précédent n'apporte rien de plus que le premier. Cependant, il permet d'aborder de plain pied une configuration théorique plus originale. Considérons pour ce faire un troisième et dernier exemple, où le système
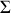 , initialement à la température
, initialement à la température
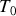 , est mis en contact thermique avec une succession de
, est mis en contact thermique avec une succession de
 thermostats
thermostats
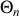 (où l'indice n est compris entre un et N ) affectés de températures
(où l'indice n est compris entre un et N ) affectés de températures
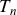 telles que :
telles que :


Parce que
 tend spontanément vers l'équilibre thermique, sa température augmente à chaque fois de la quantité
tend spontanément vers l'équilibre thermique, sa température augmente à chaque fois de la quantité
 . Après avoir été mis en contact avec le thermostat
. Après avoir été mis en contact avec le thermostat
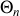 , le système
, le système
 est à la température
est à la température
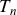 . Il entre alors en contact avec
. Il entre alors en contact avec
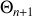 et sa température s'élève à
et sa température s'élève à
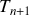 . Si
. Si
 est très grand, on peut confondre
est très grand, on peut confondre
 avec une quantité différentielle
avec une quantité différentielle
 , et les variations d'entropie de
, et les variations d'entropie de
 et de
et de
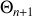 consécutives à l'échange thermique sont respectivement:
consécutives à l'échange thermique sont respectivement:

Il apparaît alors que la variation d'entropie de l'Univers (
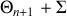 ) est nulle. Ici, l'échange thermique est réversible. Mais cette réversibilité n'est possible que parce que les températures
) est nulle. Ici, l'échange thermique est réversible. Mais cette réversibilité n'est possible que parce que les températures
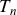 et
et
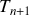 sont très proches. Autrement dit, il y a réversibilité parce que l'interaction thermique est isotherme (les deux systèmes
sont très proches. Autrement dit, il y a réversibilité parce que l'interaction thermique est isotherme (les deux systèmes
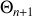 et
et
 échangent par chaleur tout en étant quasiment à la même température). En multipliant les sources thermiques intermédiaires pour modifier la température d'un corps par des moyens uniquement thermiques, un opérateur diminue donc le caractère irréversible qui accompagne normalement cette modification.
échangent par chaleur tout en étant quasiment à la même température). En multipliant les sources thermiques intermédiaires pour modifier la température d'un corps par des moyens uniquement thermiques, un opérateur diminue donc le caractère irréversible qui accompagne normalement cette modification.




