Soit un système
 qui n'échange que du travail
qui n'échange que du travail
 avec le milieu extérieur. Un tel système est dit "adiabatique'' ou bien "source de travail''. Quant au milieu extérieur, il consiste en un "opérateur'' M (c'est un machiniste qui donne ou récupère du travail). De façon symbolique,
avec le milieu extérieur. Un tel système est dit "adiabatique'' ou bien "source de travail''. Quant au milieu extérieur, il consiste en un "opérateur'' M (c'est un machiniste qui donne ou récupère du travail). De façon symbolique,
 peut être représenté par un gaz contenu dans un cylindre thermiquement isolé et clos par un piston. Ce piston est relié à l'opérateur M.
peut être représenté par un gaz contenu dans un cylindre thermiquement isolé et clos par un piston. Ce piston est relié à l'opérateur M.
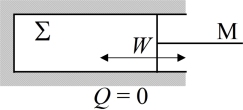
La variation d'entropie de l'Univers accompagnant un échange de travail entre
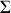 et M est égale à la somme de la variation d'entropie du système adiabatique
et M est égale à la somme de la variation d'entropie du système adiabatique
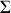 et de celle de l'opérateur M, mais la variation d'entropie de M est nulle.
et de celle de l'opérateur M, mais la variation d'entropie de M est nulle.
Par suite, d'après le 2nd principe :

Ainsi, alors même qu'aucun échange de chaleur ne se produit, l'entropie d'un système adiabatique augmente si la transformation est irréversible. Selon une terminologie du XIXème siècle, l'irréversibilité induit une "chaleur interne''
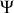 . Cette notion de chaleur interne renvoie au concept de "dégradation de l'énergie'' (de travail en chaleur) qui fut alors très utilisé.
. Cette notion de chaleur interne renvoie au concept de "dégradation de l'énergie'' (de travail en chaleur) qui fut alors très utilisé.
Plaçons nous maintenant dans le cas d'une détente ou d'une compression adiabatique non quasi-statique (
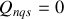 ). La variation d'énergie interne due à cette transformation est :
). La variation d'énergie interne due à cette transformation est :
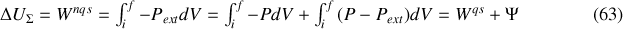
Quant à la variation d'entropie, elle se calcule sur le chemin quasi-statique équivalent :
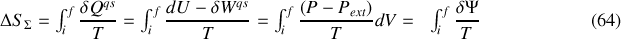
Si l'adiabatique n'est pas quasi-statique, qu'elle soit compression (
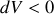 et
et
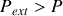 ) ou détente (
) ou détente (
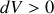 et
et
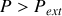 ), la quantité
), la quantité
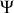 est positive. Cela montre qu'une transformation quasi-statique "équivalente'' , permettant à partir du même état initial d'aboutir au même état final, ne serait pas adiabatique et nécessiterait un transfert thermique vers le système
est positive. Cela montre qu'une transformation quasi-statique "équivalente'' , permettant à partir du même état initial d'aboutir au même état final, ne serait pas adiabatique et nécessiterait un transfert thermique vers le système
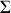 . De plus, la variation
. De plus, la variation
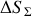 étant positive, il en est de même pour l'Univers. L'adiabatique non quasi-statique est bien irréversible.
étant positive, il en est de même pour l'Univers. L'adiabatique non quasi-statique est bien irréversible.




