Dans un volume ![]() égal à l'unité le nombre d'atomes de gaz parfait supposés obéir à la mécanique classique et ayant une vitesse comprise entre
égal à l'unité le nombre d'atomes de gaz parfait supposés obéir à la mécanique classique et ayant une vitesse comprise entre ![]() et
et ![]() est proportionnel au facteur de Boltzmann suivant
est proportionnel au facteur de Boltzmann suivant ![]() , avec :
, avec :
et donc :
ou ![]() , si on préfère exprimer en fonction des impulsions, la constante de normalisation étant différente (distribution de Maxwell-Boltzmann, établie au départ par Maxwell avec des arguments différents).
, si on préfère exprimer en fonction des impulsions, la constante de normalisation étant différente (distribution de Maxwell-Boltzmann, établie au départ par Maxwell avec des arguments différents).
Soit N le nombre d'atomes présents dans le volume considéré ![]() ,
,
et on trouve que :
en employant (formule à retenir) :
Considérons désormais une paroi orthogonale à l'axe Ox et comptons le nombre de chocs atomiques sur cette paroi, comme la quantité de mouvement transférée par chaque choc : ![]() par la règle du parallélogramme. Comme la relation de Newton s'exprime sous la forme :
par la règle du parallélogramme. Comme la relation de Newton s'exprime sous la forme :
avec ![]() , ou
, ou ![]() .
.
La pression P qui s'exerce sur la paroi est la force moyenne par unité de surface. Seules les particules allant vers les x positifs vont frapper la paroi, à qui elles vont donc transférer par unité de temps ![]() la quantité de mouvement
la quantité de mouvement ![]() et donc la force
et donc la force ![]() .
.
Par ailleurs, le nombre de chocs ![]() est proportionnel à la surface considérée, plus précisément au nombre de particules présent dans un petit volume de surface
est proportionnel à la surface considérée, plus précisément au nombre de particules présent dans un petit volume de surface ![]() et de longueur
et de longueur ![]() .
.
Finalement :
soit :
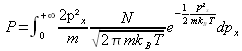
or on sait que :
et en dérivant par rapport à ![]() :
:
donc :
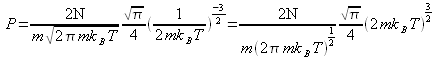
ce qui conduit à : ![]() pour un volume arbitraire et on retrouve bien la relation des gaz parfaits, ce qui est un deuxième argument pour justifier la valeur de
pour un volume arbitraire et on retrouve bien la relation des gaz parfaits, ce qui est un deuxième argument pour justifier la valeur de ![]() .
.



