C'est Frederick Soddy, chimiste, collaborant avec E. Rutherford au Québec entre 1901 et 1903 sur la désintégration des éléments radioactifs, comme l'Uranium, le Radium et le Thorium, qui a proposé que les éléments radioactifs transforment chimiquement en d'autres éléments par une variété d'étapes grâce aux émissions radioactives.
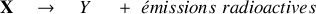
L'équation nucléaire décrit ainsi génériquement ces processus dits de désintégration nucléaire, où
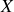 et
et
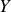 sont des éléments chimiques différents. Soddy qui devient enseignant-chercheur à l'Université de Glasgow commence en 1910 à étudier une série d'éléments radioactifs en collaboration avec Alexander Fleck, afin d'établir les caractéristiques chimiques de chaque membre connu de cette série. Leur étude a montré que dans plusieurs cas un certain nombre de membres intermédiaires de la série étaient chimiquement identiques et indiscernables l'un de l'autre, mêmes s'ils avaient subissaient des transmutations radioactives différentes.
sont des éléments chimiques différents. Soddy qui devient enseignant-chercheur à l'Université de Glasgow commence en 1910 à étudier une série d'éléments radioactifs en collaboration avec Alexander Fleck, afin d'établir les caractéristiques chimiques de chaque membre connu de cette série. Leur étude a montré que dans plusieurs cas un certain nombre de membres intermédiaires de la série étaient chimiquement identiques et indiscernables l'un de l'autre, mêmes s'ils avaient subissaient des transmutations radioactives différentes.
Exemple :
Des propriétés chimiques identiques ont été démontrées pour les dits Radium
 , Thorium
, Thorium
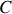 , Actinium
, Actinium
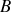 (selon la notation de l'époque). Et pourtant Radium
(selon la notation de l'époque). Et pourtant Radium
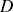 a une demi-vie d'environ 24 années (on reviendra sur le sens de demi-vie d'un élément radioactif plus tard), et un nombre de masse atomique de 210, tandis que Thorium
a une demi-vie d'environ 24 années (on reviendra sur le sens de demi-vie d'un élément radioactif plus tard), et un nombre de masse atomique de 210, tandis que Thorium
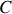 a une demi-vie de 87 minutes et un nombre de masse atomique de 212.
a une demi-vie de 87 minutes et un nombre de masse atomique de 212.
Soddy a aussi montré qu'un élément se déplace vers une position rétrogradée dans le Tableau Périodique par deux places sur émission de l'alpha, et vers une position supérieure par une place sur émission du bêta. (Voir Fig. 12)
Ces nouvelles découvertes conduisent Soddy en décembre 1913 à envoyer un article au journal Nature dans laquelle il propose d'appeler les espèces atomiques radioactives qui ont des propriétés nucléaires différentes mais qui sont chimiquement indiscernables, par le nom isotope. Cette appellation qui signifie même place en Grec lui a été suggérée initialement par Margaret Todd. Plus tard, J.J. Thomson a pu montrer que les éléments non-radioactifs peuvent avoir aussi des isotopes.
Rappel :
F. Soddy a reçu le prix Nobel de chimie en 1921 pour ses recherches sur la désintégration radioactive et sa formulation du concept d'isotope.
La découverte du neutron par Chadwick en 1932 a clarifié davantage le sujet d'isotopes. En effet les isotopes d'un même élément correspondent aux possibilités naturelles (ou artificielles) de doter le même noyau par différent nombres de neutrons pour un et le même nombre de protons. Ainsi, on peut écrire les isotopes d'un même élément d'une manière générique dans une notation courante aujourd'hui :
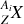
Le nombre de masse atomique
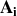 varie par isotope, pour
varie par isotope, pour
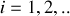 , donc le nombre de neutrons,
, donc le nombre de neutrons,
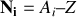 varie par isotope. Le nombre d'électrons égal au nombre de protons, ne change pas par isotope, si bien que les propriétés chimiques des isotopes sont identiques.
varie par isotope. Le nombre d'électrons égal au nombre de protons, ne change pas par isotope, si bien que les propriétés chimiques des isotopes sont identiques.
Remarque :
Les noyaux ayant la même valeur de
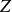 sont appelés les isotopes, ceux ayant la même valeur de
sont appelés les isotopes, ceux ayant la même valeur de
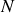 sont appelés les isotones et ceux ayant la même valeur de
sont appelés les isotones et ceux ayant la même valeur de
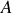 sont appelés les isobares. Enfin, un nucléide est l'ensemble des espèces ayant le même noyau.
sont appelés les isobares. Enfin, un nucléide est l'ensemble des espèces ayant le même noyau.




