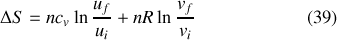La quantité différentielle d'énergie
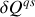 que
que
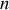 moles de gaz parfait sont susceptibles d'échanger par chaleur s'exprime en fonction de la température
moles de gaz parfait sont susceptibles d'échanger par chaleur s'exprime en fonction de la température
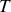 et du volume
et du volume
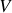 sous la forme :
sous la forme :
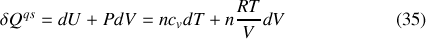
où
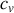 désigne la capacité thermique molaire à volume constant du gaz parfait. Prenant en considération l'égalité du rapport
désigne la capacité thermique molaire à volume constant du gaz parfait. Prenant en considération l'égalité du rapport
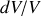 des volumes absolus et du rapport
des volumes absolus et du rapport
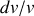 des volumes molaires 8, l'entropie différentielle d'un gaz parfait peut s'écrire :
des volumes molaires 8, l'entropie différentielle d'un gaz parfait peut s'écrire :
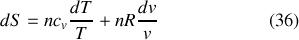
Dans l'hypothèse où
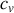 reste constante quelle que soit la température, l'intégrale
reste constante quelle que soit la température, l'intégrale
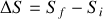 entre les états initial (i) et final (f) devient :
entre les états initial (i) et final (f) devient :
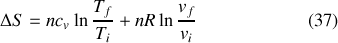
Explication :
Paradoxe de Gibbs
Il est généralement possible d'utiliser le rapport des volumes absolus à la place du rapport des volumes molaires, puisque ces deux rapports sont identiques. Cependant, cette utilisation peut conduire à un paradoxe, dit "de Gibbs''.
Pour illustrer celui-ci, effectuons le mélange de deux mêmes quantités
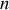 des gaz (A) et (B), initialement de mêmes volumes
des gaz (A) et (B), initialement de mêmes volumes
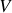 et à la même température
et à la même température
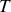 . L'ensemble (A+B) reste isolé du reste de l'Univers. A l'issue du mélange, chacun des deux gaz parfaits est resté à sa température initiale mais a vu ses volumes absolu et molaire doubler en
. L'ensemble (A+B) reste isolé du reste de l'Univers. A l'issue du mélange, chacun des deux gaz parfaits est resté à sa température initiale mais a vu ses volumes absolu et molaire doubler en
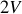 et
et
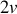 . D'après l'équation (37), qu'elle soit exprimée en fonction du rapport des volumes absolus ou des volumes molaires, la variation d'entropie de (A+B) est :
. D'après l'équation (37), qu'elle soit exprimée en fonction du rapport des volumes absolus ou des volumes molaires, la variation d'entropie de (A+B) est :
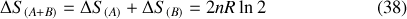
C'est là une variation positive d'entropie du système isolé (A+B) caractérisant l'irréversibilité du mélange. Toutefois, cette variation apparaît paradoxale si les deux gaz sont de natures identiques. Dans ce cas, le mélange n'en est pas un et l'état final est rigoureusement semblable à l'état initial. Le paradoxe disparaît dès lors que c'est bien le volume molaire
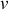 qui est considéré. Si en effet les deux gaz parfaits sont de natures identiques, le volume molaire ne subit aucune variation entre l'état initial et l'état final et la variation d'entropie est nulle.
qui est considéré. Si en effet les deux gaz parfaits sont de natures identiques, le volume molaire ne subit aucune variation entre l'état initial et l'état final et la variation d'entropie est nulle.
Explication :
Variation d'entropie en fonction des énergies internes et volumes
Dans l'équation (37), le rapport des températures peut être remplacé par le rapport des énergies internes. En effet, si la capacité thermique peut être assimilée à une constante, température et énergie interne sont proportionnelles. Mais, comme pour les volumes, c'est le rapport des énergies internes molaires
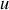 qui doit être privilégié pour une expression rigoureuse de la variation d'entropie du gaz parfait :
qui doit être privilégié pour une expression rigoureuse de la variation d'entropie du gaz parfait :