Pour un corps pur incompressible dont la capacité thermique massique
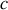 serait constante avec la température, le calcul de l'entropie conduirait à l'expression :
serait constante avec la température, le calcul de l'entropie conduirait à l'expression :
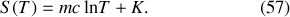
La présence d'une constante d'intégration arbitraire
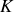 et la nature de la fonction logarithme, divergente quand la température tend vers zéro, montrent que cette expression n'a pas de caractère universel et que sa validité est limitée à un certain intervalle de températures loin du zéro absolu. La même remarque peut être formulée pour l'entropie du gaz parfait, ou de tout autre corps.
et la nature de la fonction logarithme, divergente quand la température tend vers zéro, montrent que cette expression n'a pas de caractère universel et que sa validité est limitée à un certain intervalle de températures loin du zéro absolu. La même remarque peut être formulée pour l'entropie du gaz parfait, ou de tout autre corps.
Le problème posé par le logarithme, primitive de la différentielle
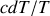 , peut être résolu si l'on considère qu'en réalité la capacité thermique d'un corps n'est pas constante avec la température, et qu'elle décroît même rapidement vers zéro lorsque la température s'approche du zéro absolu. Les observations sur les corps solides faites dès la fin du XIXème siècle montrent qu'au voisinage de 0 K, la capacité
, peut être résolu si l'on considère qu'en réalité la capacité thermique d'un corps n'est pas constante avec la température, et qu'elle décroît même rapidement vers zéro lorsque la température s'approche du zéro absolu. Les observations sur les corps solides faites dès la fin du XIXème siècle montrent qu'au voisinage de 0 K, la capacité
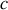 est proportionnelle à
est proportionnelle à
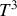 . Les calculs quantiques le justifient également. Par suite, l'entropie ne présente pas de singularité au zéro absolu :
. Les calculs quantiques le justifient également. Par suite, l'entropie ne présente pas de singularité au zéro absolu :
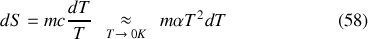
Le caractère arbitraire de la constante
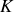 peut d'autre part être dépassé en l'associant par convention à un état de référence universel (ayant une signification physique). Walther Nernst proposa que cet état soit le zéro absolu de la température thermodynamique. Max Planck suggéra de surcroît que la valeur particulière de
peut d'autre part être dépassé en l'associant par convention à un état de référence universel (ayant une signification physique). Walther Nernst proposa que cet état soit le zéro absolu de la température thermodynamique. Max Planck suggéra de surcroît que la valeur particulière de
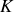 soit tout simplement zéro pour l'ensemble de tous les corps purs. De là découle l'énoncé d'un postulat parfois nommé "troisième principe de la thermodynamique'' :
soit tout simplement zéro pour l'ensemble de tous les corps purs. De là découle l'énoncé d'un postulat parfois nommé "troisième principe de la thermodynamique'' :
Fondamental :
Postulat de Nernst-Planck
L'entropie de toute substance pure tend vers une limite finie lorsqu'on s'approche du zéro absolu. Cette limite est indépendante de la pression. On la pose égale à zéro par définition de l'entropie de référence.




